武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
免疫组化抗体技术指南:如何选择、验证抗体并排除染色故障——病理诊断与科研研究的实用手册
29 人阅读发布时间:2026-02-11 14:21
免疫组化(IHC)技术通过抗原-抗体特异性结合,利用标记的二抗对组织中的特定抗原进行定位和定量分析,是病理诊断和科研研究的重要工具。然而,抗体的选择、验证及染色故障的排除直接影响实验结果的准确性和可靠性。本文将从抗体选择、验证及染色故障排除三个方面进行系统阐述。
免疫组化抗体的选择、验证与对照设置
成功的IHC实验始于抗体的谨慎选择与严格验证。由于不同抗体克隆针对同一靶蛋白的不同表位,且其性能在不同实验方法(如Western Blot与IHC)间可能存在显著差异,因此选择时必须考虑其已验证的应用场景,明确实验目的与抗原特性。
样本类型确定:石蜡包埋(FFPE)vs 冰冻切片
样本的处理方式直接影响抗体的表现和实验方案的制定。石蜡切片需选择经过抗原修复验证的抗体,而冰冻切片抗体可能不适用于石蜡样本。
● 观察实验样本的类型
明确是经过福尔马林固定、石蜡包埋(FFPE)的组织切片,还是新鲜取材后直接冷冻保存的切片。两种样本的抗原保存状态不同:FFPE样本因固定和脱水过程可能导致部分抗原表位被掩盖,需通过抗原修复(如热修复或酶修复)暴露;冷冻样本抗原结构更接近原始状态,但可能因冰晶形成导致组织形态受损。
● 样本预处理
若为FFPE样本,需进行脱蜡(二_甲_苯_浸泡)和水化(梯度酒精至蒸馏水),随后进行抗原修复(如柠檬酸缓冲液煮沸或高压修复)。
若为冷冻样本,直接从-80℃取出后平衡至室温,用丙酮或甲醇固定(避免福尔马林固定导致抗原交联)。
● 记录样本状态
观察切片厚度(通常FFPE为4-5μm,冷冻为8-10μm)、组织完整性及背景颜色,为后续结果分析提供依据。
根据样本类型选择抗体。例如,FFPE样本需优先选择经过验证的"石蜡适用"抗体(通常标注为"for IHC-P"),而冷冻样本可选择"冰冻适用"或"多用途"抗体。若抗体说明书未明确说明,需通过预实验验证其兼容性。
预期染色模式与对照设置
● 明确抗体在目标组织中的预期染色模式
错误的定位(例如本应膜表达的蛋白出现核染色)可能提示非特异性结合。
细胞类型:如上皮细胞、淋巴细胞、肿瘤细胞等。
亚细胞定位:细胞核(如Ki-67)、细胞质(如β-catenin)、细胞膜(如PD-L1)或细胞外基质(如胶原蛋白)。
● 设置对照
阳性对照:选择已知表达目标蛋白的组织(如乳腺癌组织中的ER/PR,或正常肾脏组织中的AQP2)作为阳性对照,验证抗体有效性。
阴性对照:使用同型IgG(非免疫血清)或省略一抗,确认非特异性结合(如背景着色或假阳性)。
● 根据预期模式调整实验条件
例如,若目标蛋白位于细胞核,需确保抗原修复充分(如高压修复比热修复更有效);若为膜蛋白,需避免过度固定导致膜结构破坏。若预期结果与文献不符,需排查抗体浓度、修复条件或样本质量问题。
种属反应性与实验背景
● 种属反应性是抗体选择的基础
首先,确保抗体能识别目标蛋白所属的种属(如人、小鼠、大鼠)。其次,在免疫组化中,还需考虑一抗与样本种属的匹配,以避免二抗与样本内源性免疫球蛋白产生交叉反应。因此应首先确认抗体说明书中的“种属反应性”(Species Reactivity),即抗体能否识别实验样本的种属来源(如人、小鼠、大鼠等)。同时需考虑应用类型和具体需求。
应用类型:免疫组化(IHC)、免疫荧光(IF)或流式细胞术(FC)。不同应用需不同抗体克隆号(如IHC专用抗体可能经过交联修饰)。
多重染色需求:若需同时检测多个蛋白,需选择不同种属来源的抗体(如一抗来自兔,二抗标记抗兔IgG;另一一抗来自小鼠,二抗标记抗小鼠IgG),避免交叉反应。
● 验证抗体交叉反应
若实验样本为转基因小鼠(表达人源蛋白),需确认抗体是否同时识别小鼠和人源抗原(如“Cross-reacts with human and mouse”)。
若样本为非标准种属(如斑马鱼),需通过Western blot预实验验证抗体特异性。
优化抗体浓度:
进行梯度稀释(如1:50、1:100、1:200),通过预实验确定最佳浓度(背景低且信号强)。
● 正式开展实验
按优化条件处理样本(修复、封闭、孵育一抗/二抗)。
显色后观察结果,对比预期模式与实际染色(如定位是否一致、强度是否合理)。
若结果异常,回顾前三步(样本类型、预期模式、种属反应性)并调整参数(如更换抗体、调整修复时间或浓度)。
免疫组化中单克隆与多克隆抗体的选择(快速比较)
单克隆抗体与多克隆抗体各有优劣,选择取决于实验的具体需求。
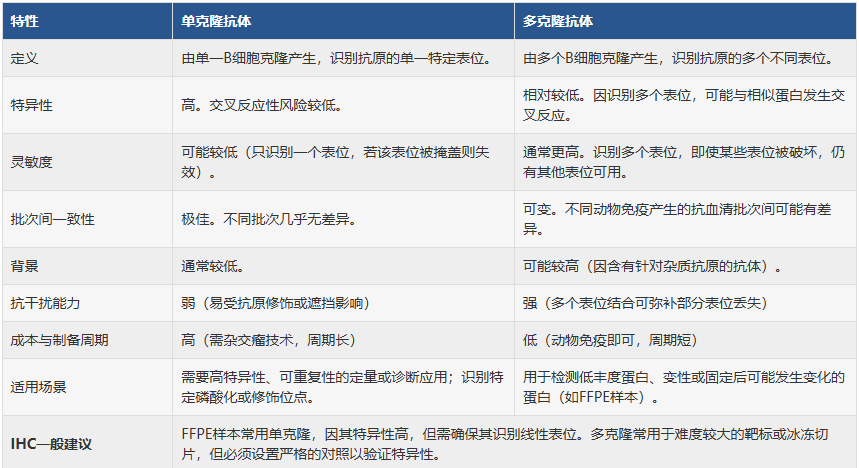
若需高特异性定位(如PD-L1在肿瘤细胞膜的表达),优先选择单克隆抗体。
若需高敏感性检测(如炎症因子在石蜡组织中的弱表达),可尝试多克隆抗体,但需严格验证特异性(如通过吸收实验排除非特异性结合)。
好的IHC验证证据应包含哪些内容
● 特异性验证
吸收实验(Competition/Spike-in实验):使用过量的目标抗原与抗体预孵育,若后续染色信号明显减弱或消失,可证明抗体与目标蛋白的结合具有特异性。
基因敲除/沉默对照:在目标基因敲除(KO)或敲低(如siRNA处理)的细胞或组织样本中,应基本无染色信号,作为阴性对照的重要依据。
● 敏感性验证
梯度稀释测试:通过系列稀释确定抗体的最佳工作浓度,例如1:100稀释下仍能清晰染色,而1:200时信号明显减弱,有助于明确检测下限。
低丰度蛋白检测:在已知低表达目标蛋白的组织(如某些正常组织)与高表达组织(如对应肿瘤)中进行染色比较,验证抗体是否能稳定检测出低水平表达。
● 种属交叉反应验证
若抗体说明书注明可应用于多种属(如“人/小鼠通用”),应在不同种属的组织中分别验证,确保染色模式一致,避免交叉反应差异导致的假象。
● 应用类型验证
确认抗体明确标注适用于IHC实验,并建议参考已发表的IHC染色图像(如产品说明书或相关文献中的典型结果),作为预期染色模式的依据。
● 批次间一致性验证
尤其是多克隆抗体,不同批次间可能存在差异。建议对不同批次的抗体进行平行染色实验,确保染色强度与模式无明显差异。
所有验证实验应保存完整的图像与数据记录,整理成验证报告,例如包含吸收实验阴性对照图、基因敲除样本无染色结果等,作为实验可重复性的支持材料。
若验证过程中发现非特异性染色强、信号弱或无信号等问题,可能需考虑更换抗体或进一步优化实验条件,如调整抗原修复方法、降低抗体浓度等。
浏览已验证的IHC抗体
基本优化方案(稀释度 + 抗原修复)
在免疫组化实验中,通过有限次的系统化测试快速确定最佳工作条件,既能保证染色质量,又能节省时间与试剂。
● 抗体稀释度优化
首先固定抗原修复条件(例如采用柠檬酸缓冲液进行高压修复10分钟),然后进行以下步骤。
选择3–5个稀释度(如1:50、1:100、1:200、1:400),对同一批组织样本进行平行染色。对比观察染色结果。
最佳稀释度:信号清晰且非特异性背景最低(例如在1:200时肿瘤细胞核强阳性,周围间质无着色)。
需排除的稀释度:浓度过高(如1:50)易导致背景过深;浓度过低(如1:400)则信号微弱,均不适用于正式实验。
● 抗原修复条件优化
在确定抗体最佳稀释度的基础上,进一步优化抗原修复方法。
固定抗体稀释度(例如1:200)
比较2–3种常用修复方法:
热修复:柠檬酸缓冲液适用于多数核抗原(如Ki-67);EDTA缓冲液更适合膜蛋白或某些难以暴露的抗原(如EGFR)。
酶修复:如蛋白酶K或胰蛋白酶,一般仅用于福尔马林固定后抗原严重遮蔽的情况,使用时需严格控制时间,以防组织损伤。
根据目标蛋白的定位与染色清晰度,选择信噪比最高的修复方案。
● 优化结果的记录与后续步骤
将最终确定的条件(例如“抗体稀释度1:200 + 柠檬酸缓冲液高压修复10分钟”)列入实验操作流程,作为后续实验的统一标准。若优化后染色效果仍不理想,可进一步检查其他可能影响的环节,如封闭时间、二抗浓度或显色系统等,逐步完善实验体系。
查看完整HC实验方案
本文全文较长,后面还包含:如何验证免疫组化染色、IHC染色问题排查与解决方案、常见问题答疑等内容,如需查看全文可跳转链接(点蓝字可跳转)查看。



