武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
CRLF2(TSLPR): 连接2型炎症与血液肿瘤的关键靶点
66 人阅读发布时间:2025-12-12 13:54
胸腺基质淋巴细胞生成素受体(TSLPR,又称CRLF2)是介导上皮源性细胞因子TSLP信号传导的关键受体亚单位,与IL-7Rα共同构成功能性受体复合物。TSLP/TSLPR通路在调控2型炎症反应中处于上游枢纽位置,不仅参与哮喘、慢性鼻窦炎伴鼻息肉(CRSwNP)和慢性阻塞性肺疾病(COPD)等免疫介导性疾病的发病机制,还在Ph样急性淋巴细胞白血病等血液肿瘤中因异常激活而驱动疾病进展。
近年来,随着对TSLPR生物学功能的深入理解,该靶点逐渐成为连接炎症与肿瘤治疗的重要桥梁。其中,全球目前_唯_一_处于临床开发阶段的TSLP受体拮抗剂Verekitug(UPB-101),在2025年取得了关键性突破,进一步凸显了该靶点在慢性气道炎症性疾病中的治疗潜力。
CRLF2(cytokine receptor-like factor 2),又称胸腺基质淋巴细胞生成素受体(TSLPR),是I型细胞因子受体超家族成员,编码该蛋白的基因位于X和Y染色体的假常染色体1区(PAR1)。CRLF2本身不具激酶活性,需与白介素-7受体α链(IL-7Rα)形成异源二聚体,共同构成胸腺基质淋巴细胞生成素(TSLP)的功能性高亲和力受体复合物 [1]。
蛋白结构域组成
CRLF2为I型跨膜糖蛋白,由约370个氨基酸组成,包含一个N端胞外结构域、一个单次跨膜区和一个C端短胞内尾部。其胞外区含有I型细胞因子受体家族标志性WSXWS基序,对维持受体构象及配体结合至关重要。然而,与典型I型受体相比,CRLF2结构具有明显非典型性:其胞外结构域缺失四个保守半胱氨酸残基中的第二个,可能影响二硫键形成与整体折叠;胞内区虽保留Box1基序(用于JAK激酶锚定),却缺乏经典的Box2结构域;此外,其胞内尾部仅含一个酪氨酸残基,位于羧基末端上游第4位,且该位点在配体结合后并不发生磷酸化。这些特征表明,CRLF2自身无法独立完成完整的信号转导,必须依赖共受体提供功能补偿。
受体复合物组装与配体识别
CRLF2自身无法独立传导信号,必须与IL-7Rα共表达并形成异源二聚体,方能高亲和力结合TSLP。TSLP首先与CRLF2的D1结构域结合,诱导构象变化后招募IL-7Rα,最终形成稳定的三元复合物。这一组装机制不仅实现了高亲和力配体识别,还确保了信号激活的时空精确性,避免非特异性免疫激活。
非经典的JAK-STAT激活机制
TSLP结合CRLF2/IL-7Rα复合物后,可诱导下游信号级联。传统观点认为该过程涉及JAK1(结合IL-7Rα)与JAK2(结合CRLF2)的反式磷酸化,进而激活STAT5。然而,深入研究表明,TSLP诱导的STAT5活化并不依赖典型的JAK激酶活性——显性负性JAK1或JAK2无法阻断该过程,而Tec家族激酶的抑制则可部分削弱STAT5磷酸化,提示Tec激酶可能在该通路中发挥关键作用。此外,STAT5的激活与其驱动的细胞增殖功能并非线性耦合:STAT5活化不依赖CRLF2胞内_唯_一_的酪氨酸残基,而该位点对细胞增殖却至关重要。
多通路协同调控细胞命运
除STAT5外,TSLP/CRLF2信号还可激活多条平行通路。Src家族激酶参与调控细胞增殖,其抑制剂可显著阻断TSLP诱导的增殖反应,但不影响STAT5磷酸化。同时,该通路亦可激活MAPK/ERK和PI3K/AKT/mTOR通路,分别调控细胞周期进程与抗凋亡程序。在病理状态下,如Ph-like急性淋巴细胞白血病中,CRLF2的异常表达或突变可导致这些通路持续活化,共同驱动白血病克隆的扩增与存活。
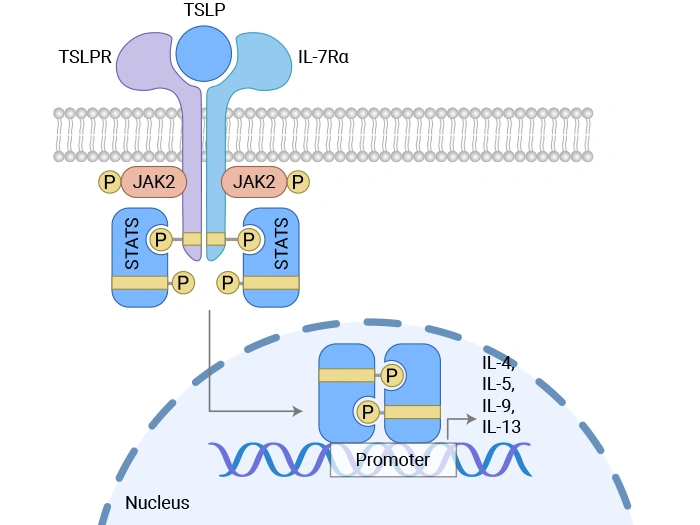
胸腺基质淋巴细胞生成素诱导信号传导的机制
图. 胸腺基质淋巴细胞生成素诱导信号传导的机制 [2]
01.CRLF2与Ph样急性淋巴细胞白血病
CRLF2异常是费城染色体样急性淋巴细胞白血病(Philadelphia chromosome–like acute lymphoblastic leukemia, Ph-like ALL)中最常见且最具临床意义的分子特征之一。Ph-like ALL 是一种高危B细胞前体急性淋巴细胞白血病(BCP-ALL)亚型,其基因表达谱与费城染色体阳性(Ph+)ALL相似,但缺乏BCR-ABL1融合基因,取而代之的是多种激酶通路激活的遗传改变,其中CRLF2重排或过表达占比最高 [3]。临床上,CRLF2高表达与初诊高白细胞计数、诱导治疗后微小残留病(MRD)清除不佳、复发风险升高及生存率下降显著相关 [4]。目前,CRLF2已被纳入国际ALL诊疗指南作为Ph-like ALL的核心诊断标志,并成为靶向治疗的重要突破口。
02.CRLF2与哮喘
在哮喘,尤其是重度嗜酸性或Th2高型哮喘中,气道上皮细胞因环境刺激(如过敏原、病毒、污染物)损伤而大量分泌TSLP。TSLP通过结合树突状细胞、2型固有淋巴细胞(ILC2s)和Th2细胞表面的CRLF2/IL-7Rα复合物,激活STAT5/STAT3通路,促进IL-4、IL-5、IL-13等2型细胞因子释放,驱动嗜酸性粒细胞浸润、气道高反应性和黏液高分泌。临床研究显示,哮喘患者支气管活检组织和血清中TSLP及CRLF2表达水平显著升高,且与疾病严重程度正相关 [5]。
03.CRLF2与过敏
TSLP作为过敏性炎症级联反应的上游关键因子,通过其受体TSLPR(CRLF2)激活树突状细胞、Th2细胞和ILC2,驱动2型免疫应答;研究显示,新型抗TSLPR全人源单克隆抗体ASP7266可有效阻断TSLP信号传导,抑制TSLP诱导的细胞增殖、趋化因子CCL17释放、Th2分化及ILC2来源的IL-5产生,并在食蟹猴模型中完全抑制过敏性皮肤反应,展现出优于或媲美tezepelumab的临床前药理活性,有望成为哮喘、慢性鼻窦炎伴鼻息肉和特应性皮炎等过敏性疾病的新一代靶向治疗选择 [6]。
当前针对TSLPR(即CRLF2)靶点的在研药物涵盖多种药物类型,包括单克隆抗体、抗体偶联药物(ADC)和双特异性抗体(BsAb)。在过敏炎症性疾病领域,以阻断配体-受体相互作用为核心的单克隆抗体(如处于临床2期的Verekitug)进展较快;而在血液肿瘤(尤其是Ph样急性淋巴细胞白血病)领域,研发聚焦于通过抗体偶联药物和双特异性抗体等新型技术实现靶向细胞杀伤,但目前多项在研项目尚处于临床前探索阶段,整体转化进程仍属早期。
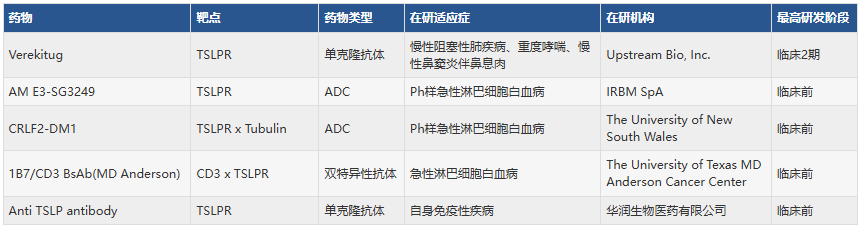
(数据截止到2025年11月20日,来源于synapse)
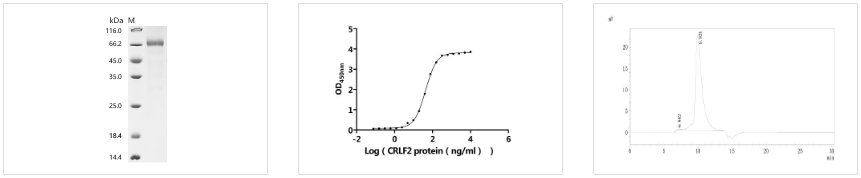
● CRLF2重组蛋白
Recombinant Human Cytokine receptor-like factor 2 (CRLF2), partial (Active); CSB-MP005983HUd9
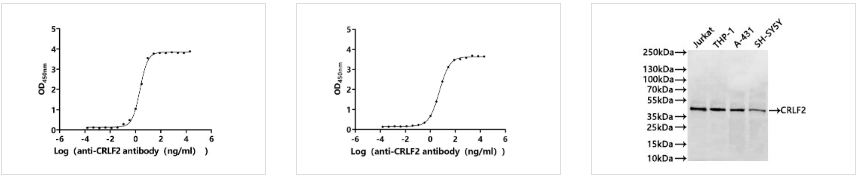
● CRLF2抗体
CRLF2 (Verekitug) Recombinant Monoclonal Antibody; CSB-RA005983MA1HU
[1] Liu Y J, Soumelis V, Watanabe N, et al. TSLP: an epithelial cell cytokine that regulates T cell differentiation by conditioning dendritic cell maturation. Annu Rev Immunol. 2007; 25: 193-219.
[2] Ebina-Shibuya R,Leonard W J. Role of thymic stromal lymphopoietin in allergy and beyond. Nat Rev Immunol. 2023;23 (1):24-37.
[3] Potter N, Jones L, Blair H, et al. Single-cell analysis identifies CRLF2 rearrangements as both early and late events in Down syndrome and non-Down syndrome acute lymphoblastic leukaemia. Leukemia. 2019;33 (4):893-904.
[4] Jiang M, Zou X, Lu L. Potential efficacy and prognosis of silencing the CRLF2‑mediated AKT/mTOR pathway in pediatric acute B‑cell lymphoblastic leukemia. Oncol Rep. 2019;41 (2):885-894.
[5] Malik B, McKerrow R, Harrington J, et al. ILC2 cells from severe allergic and eosinophilic asthma demonstrate increased expression of TSLP receptor (TSLPR) and enhanced proliferative capacity. Eur Respir J. 2021;58(suppl 65):PA823.
[6] Numazaki M, Abe M, Hanaoka K, et al. ASP7266, a Novel Antibody against Human Thymic Stromal Lymphopoietin Receptor for the Treatment of Allergic Diseases. J Pharmacol Exp Ther. 2022;380 (1):26-33.
*免责声明:华美生物内容团队仅是分享和解读公开研究论文及其发现,本文仅作信息交流,文中观点不代表华美生物立场,请理解。



