武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
癌症治疗新靶点:FAP——从肿瘤微环境调控到诊疗一体化的突破之路
576 人阅读发布时间:2025-11-17 14:15
成纤维细胞活化蛋白(FAP)作为肿瘤微环境的核心调控因子,正成为癌症诊疗领域的关键突破口。本文系统解析FAP在肿瘤进展、免疫逃逸及纤维化疾病中的双重作用机制,全面梳理靶向FAP的双特异性抗体、CAR-T疗法等前沿药物研发进展,探讨其从基础研究到临床转化的潜在价值,为肿瘤治疗策略优化提供新视角。
1. FAP研究的背景与意义
2. FAP的生物学特性、结构与生理功能
3. FAP在疾病中的作用机制与信号通路
4. FAP靶向药物研发进展
5. FAP研究工具
1. FAP研究的背景与意义
成纤维细胞活化蛋白(Fibroblast Activation Protein, FAP)是一种II型跨膜丝氨酸蛋白酶,在正常生理状态下表达较低,但在多种病理条件下,尤其是在肿瘤微环境中,其表达显著上调,因此引起了广泛关注 [1-4]。FAP最初因其在活化成纤维细胞上的表达而得名,并在多种疾病中,特别是纤维化、炎症和癌症中发挥重要作用 [4]。作为一种蛋白水解酶,FAP能够切割细胞外基质(ECM)中的蛋白质,影响细胞间的相互作用和组织重塑,进而促进疾病的发展 [1]。
FAP的表达模式使其成为潜在的生物标志物和治疗靶点。研究表明,FAP在超过90%的癌症类型(如乳腺癌、胰腺癌、食管癌和肺癌)中的癌症相关成纤维细胞(CAFs)上高度表达,而在健康成人组织中几乎不表达 [2][3][5][6]。这种病理特异性表达赋予了FAP作为癌症诊断和治疗靶点的巨大潜力 [6]。
2. FAP的生物学特性、结构与生理功能
FAP具有独特的酶学活性,能够特异性识别和降解细胞外基质中的富含脯氨酸的成分(如胶原蛋白和明胶)[1][8]。在正常成人组织中,FAP的表达水平通常较低,仅在胚胎发育、创伤愈合等特定生理过程中呈现上调 [1][4]。然而,在多种病理条件下,尤其是在肿瘤微环境中,FAP的表达显著上调,并成为癌症相关成纤维细胞的标志物 [2][5]。
2.1 FAP的结构与酶学特性
FAP属于二肽基肽酶(Dipeptidyl Peptidase, DPP)家族,是一种具有脯氨酸特异性的后脯氨酰蛋白水解酶 [10][8]。其酶学活性使其能够切割多种细胞外基质成分,参与组织重塑和病理进程 [1]。在正常组织中,FAP的表达较低,但在胚胎发育、创伤修复等过程中会短暂上调,以支持组织修复 [4]。
2.2 FAP在正常组织中的表达与生理作用
尽管FAP在正常成人组织中表达水平较低,但在一些生理过程中,如胚胎发育和创伤愈合等,FAP会暂时性地上调,并发挥重要的生理作用 [1][4]。FAP通过促进成纤维细胞的迁移和增殖,以及参与细胞外基质的重塑,支持组织的再生和修复 [4]。这种受控的表达和功能展示了FAP在维持组织稳态中的关键作用 [4]。
3. FAP在疾病中的作用机制与信号通路
FAP在多种疾病,尤其是肿瘤中的作用,主要通过细胞外基质的重塑和细胞内信号传导的调控,影响肿瘤细胞的生物学行为。FAP在肿瘤微环境中的表达促进了癌症细胞的侵袭、转移和治疗抵抗。FAP不仅通过其酶学活性降解细胞外基质,还通过激活多个关键信号通路,调控细胞增殖、存活、迁移和免疫逃逸 [10][11]。
3.1 FAP与细胞外基质重塑及细胞粘附
FAP在肿瘤微环境中通过降解细胞外基质中的成分,影响肿瘤细胞与基质的粘附和迁移。研究表明,FAP通过整合素家族成员与细胞外基质的相互作用,激活黏着斑激酶(FAK)信号通路,促进肿瘤的侵袭和转移 [10]。在非小细胞肺癌(NSCLC)中,FAP通过调控整合素与ECM成分的结合,进一步促进肿瘤转移 [11]。此外,FAP与整合素之间的相互作用改变了肿瘤细胞的粘附强度和迁移能力,从而为肿瘤细胞的侵袭提供了有利条件 [11]。
3.2 FAP介导的细胞内信号传导与细胞行为调控
FAP通过多种信号通路调控肿瘤细胞的增殖、存活和迁移。例如,在结直肠癌(CRC)中,FAP通过激活肿瘤坏死因子受体2(TNFR2)/Akt或ERK信号通路,促进成纤维细胞的增殖和迁移 [17]。FAP还通过与Yes关联蛋白(YAP1)的相互作用,调控细胞增殖和免疫逃逸。例如,在高级别浆液性卵巢癌(HGSOC)中,FAP+ CAFs通过YAP1依赖的机制,抑制CD8+ T细胞的细胞毒性,降低免疫反应,从而导致患者预后不良 [15]。
FAP还与转化生长因子-β(TGF-β)通路密切相关,TGF-β通过FAP/VCAN轴促进膀胱癌细胞的上皮-间充质转化(EMT),增强肿瘤细胞的侵袭性 [16]。这些发现揭示了FAP在肿瘤微环境中的重要作用,尤其是在肿瘤细胞增殖和免疫逃逸中的多重机制 [11][17]。
3.3 FAP与肿瘤微环境的相互作用
FAP阳性成纤维细胞(CAFs)在肿瘤微环境中发挥多重作用,尤其在免疫逃逸、治疗抵抗和肿瘤转移中起着至关重要的作用。FAP+ CAFs通过分泌免疫抑制因子,如IL-8,诱导肿瘤细胞的放疗抵抗 [22]。此外,FAP+ CAFs还通过改变细胞外基质的成分,阻止免疫细胞的浸润,形成“冷”肿瘤微环境,进一步促进肿瘤的免疫逃逸 [20]。
FAP通过与CXCL12等因子的相互作用,促进CAF的免疫抑制功能。例如,在胃癌中,FAP+ CAFs通过分泌骨膜素(POSTN)促进巨噬细胞的趋化,并通过Akt信号通路激活免疫检查点抑制剂(ICB)的抵抗 [21]。这些研究表明,FAP在肿瘤微环境中的作用不仅局限于ECM重塑,还通过免疫调节、细胞迁移等机制推动肿瘤的恶性转化 [21]。
3.4 FAP在非肿瘤疾病中的作用
FAP在非肿瘤性疾病中的作用逐渐受到关注,特别是在纤维化和慢性炎症性疾病中。例如,在心肌缺血再灌注损伤(I/R)后,FAP在心肌成纤维细胞中的表达显著上调,促进了心肌纤维化 [19]。类似地,在肝纤维化中,FAP的表达水平与肝星状细胞的激活密切相关,并且FAP-α作为纤维化的标志物在临床中具有重要的诊断价值 [18]。
4. FAP靶向药物研发进展
在肿瘤领域,针对FAP的放射性药物研发非常活跃,已有多条管线处于临床阶段,并且正从单纯的诊断或治疗,向“诊疗一体化”的方向发展。另外,小分子化药、多肽偶联核素、双特异性抗体、细胞治疗药物等多种药物类型在研,部分双抗及CAR-T在研管线列举如下表:
| 药物 | 作用机制 | 药物类型 | 在研适应症(疾病名) | 在研机构 | 最高研发阶段 |
|---|---|---|---|---|---|
| RG7826 | 4-1BB激动剂 | FAP拮抗剂 | 双特异性抗体 | 结直肠癌 | Roche Holding AG | 临床1/2期 |
| RO-7567132 | FAP拮抗剂 | TNFRSF3 agonists | 双特异性抗体 | 晚期恶性实体瘤 | 局部晚期恶性实体瘤 | 转移性实体瘤 | Hoffmann-La Roche Ltd. | 临床1期 |
| RO-7300490 | CD40L刺激剂 | FAP调节剂 | 双特异性抗体 | 局部晚期恶性实体瘤 | Hoffmann-La Roche, Inc. | 临床1期 |
| BMS-986484 | CD40抑制剂 | FAP拮抗剂 | 双特异性抗体 | 晚期恶性实体瘤 | Bristol Myers Squibb Co. | 临床1期 |
| SHR-7367 | CD40激动剂 | FAP拮抗剂 | 双特异性抗体 | 晚期癌症 | 晚期恶性实体瘤 | KRAS G12D突变实体瘤 | 上海恒瑞医药有限公司 | 临床1期 |
| BI-765179 | 4-1BB激动剂 | FAP调节剂 | 双特异性抗体 | 晚期恶性实体瘤 | 局部晚期恶性实体瘤等 | Boehringer Ingelheim International GmbH | Boehringer Ingelheim GmbH | 临床1期 |
| GEN1057 | DR4激动剂 | FAP拮抗剂 | 双特异性抗体 | 晚期恶性实体瘤 | 转移性实体瘤 | 实体瘤 | Genmab BV | Genmab, Inc. | 临床1期 |
| AGEN1721 | FAP调节剂 | TGF-β调节剂 | 双特异性抗体 | 乳腺癌 | 结直肠癌 | Agenus, Inc. | 临床前 |
| 四价FAPxCD40双抗(恒瑞医药) | CD40激动剂 | FAP调节剂 | 双特异性抗体 | 多价疫苗 | 肿瘤 | 江苏恒瑞医药股份有限公司 | 临床前 |
| FAP靶向的CAR-T(Capstan Therapeutics) | FAP拮抗剂 | CAR-T | 纤维化 | Capstan Therapeutics, Inc. | 临床前 |
| FAP CAR T cell therapy(Acuitas) | FAP拮抗剂 | CAR-T | 心脏衰竭 | Acuitas Therapeutics, Inc. | 临床前 |
| FAP靶向CAR-T(Genethon) | FAP拮抗剂 | CAR-T | 纤维化 | 杜氏肌营养不良症 | Genethon | 临床前 |
| 抗FAP/TGF-PRII抗体(Merus) | FAP拮抗剂 | TGFBR2抑制剂 | 双特异性抗体 | 肿瘤 | Incyte Corp. | Merus NV | 临床前 |
| M-300 (Mestag) | FAP调节剂 | TNFRSF3 agonists | 双特异性抗体 | 实体瘤 | Mestag Therapeutics Ltd. | 临床前 |
| 抗OX40/FAP-α双抗(罗氏) | FAP调节剂 | OX40激动剂 | 双特异性抗体 | 肿瘤 | F. Hoffmann-La Roche Ltd. | 临床前 |
| OPTF01 | FAP拮抗剂 | CAR-T | 胶质母细胞瘤 | Optieum Biotechnologies, Inc. | 临床前 |
5. FAP研究工具
FAP作为肿瘤微环境中的关键靶点,其在肿瘤的侵袭、转移、免疫逃逸以及耐药性中发挥重要作用。华美生物提供FAP重组蛋白、抗体及ELISA试剂盒产品,助力您开发特异性靶向FAP的药物,探索其在肿瘤治疗中的应用潜力。
● FAP重组蛋白
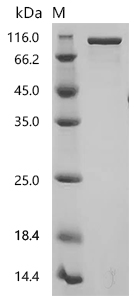
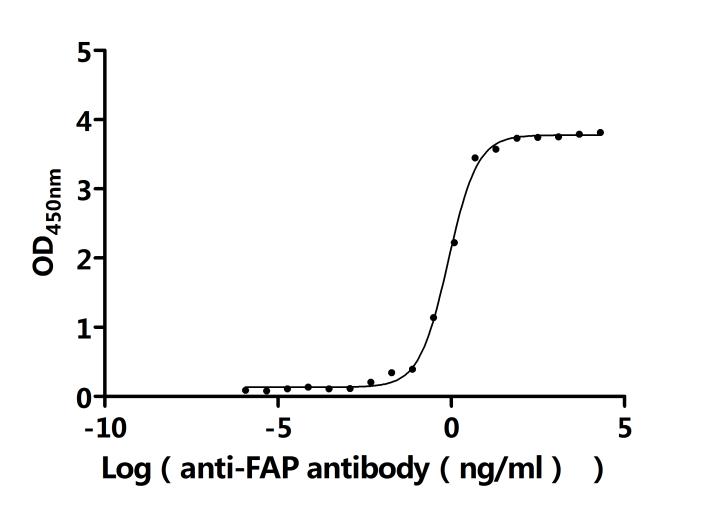
Recombinant Human Prolyl endopeptidase FAP (FAP), partial (Active); CSB-MP008424HU
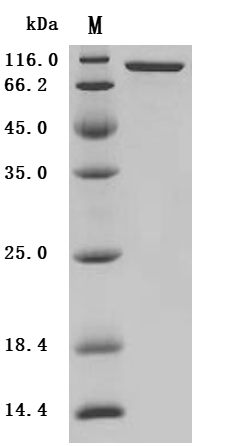
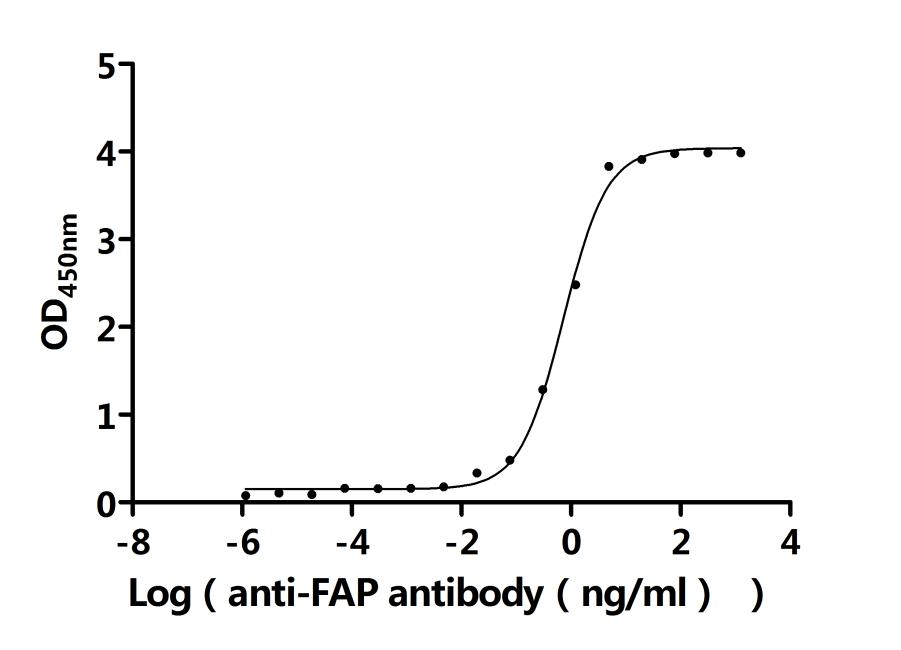
Recombinant Macaca fascicularis Fibroblast activation protein alpha (FAP), partial (Active); CSB-MP6769MOV
● FAP抗体
FAP Recombinant Monoclonal Antibody; CSB-RA008424MA1HU
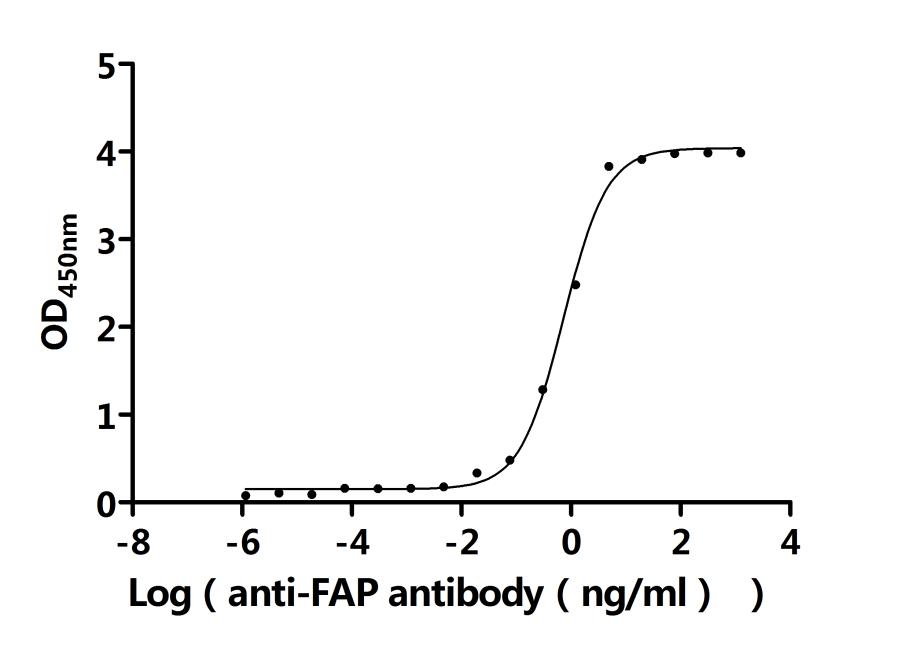
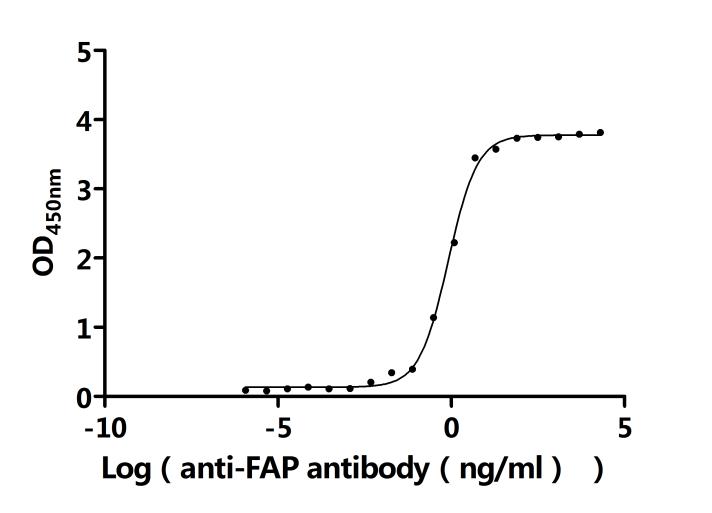
FAP Recombinant Monoclonal Antibody; CSB-RA008424MA2HU
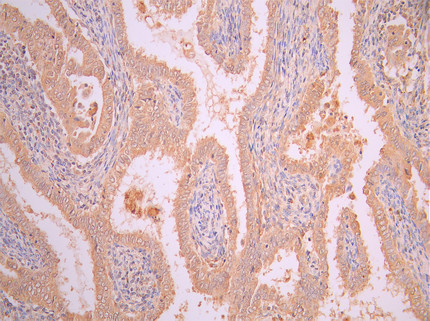
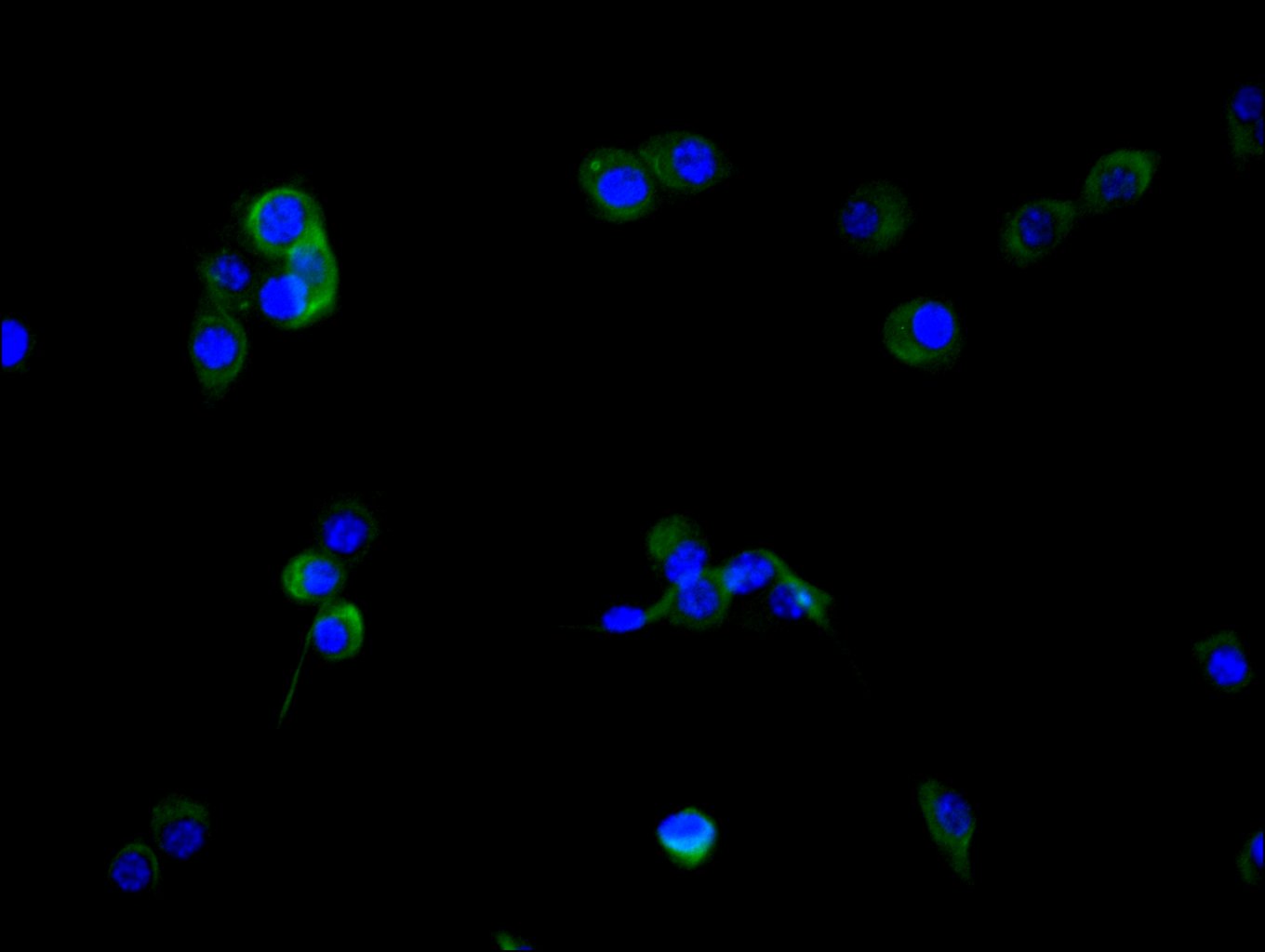
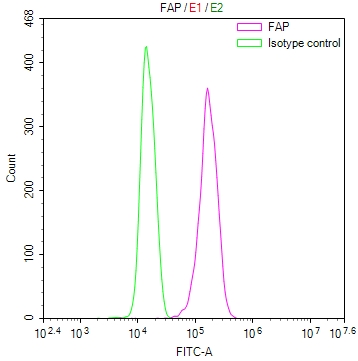
● FAP ELISA试剂盒
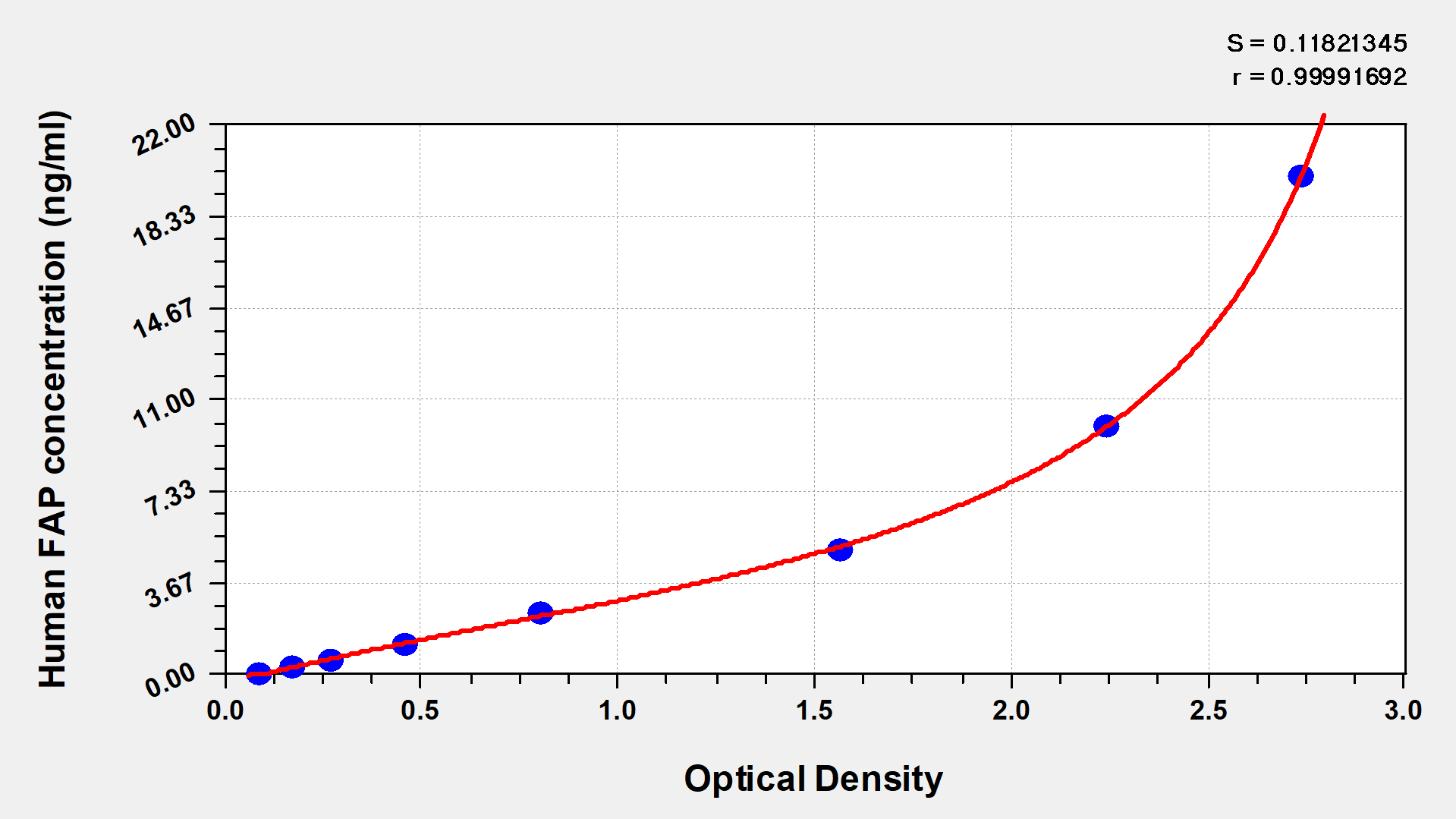
Human Seprase(FAP) ELISA kit; CSB-EL008424HU
参考文献:
[1] Rasmus S Pedersen, M. Karsdal, N. Willumsen.(2024). Abstract 4287: Serological quantification of fibroblast activation protein (FAP) cleaved type III collagen: A biomarker for FAP activity.
[2] Sebastian Dziadek, A. Kraxner, Wei-Yi Cheng, Tai-Hsien Ou Yang, Mike Flores, Noah Theiss, T. Tsao, Emilia Andersson, S. V. Harring, Ann-Marie E. Bröske, Maurizio Ceppi, Volker Teichgräber, Jehad Charo.(2024). Comprehensive analysis of fibroblast activation protein expression across 23 tumor indications: insights for biomarker development in cancer immunotherapies.
[3] K. Hartmann, Merel van Gogh, P. C. Freitag, Florian Kast, Gabriela Nagy-Davidescu, L. Borsig, A. Plückthun.(2022). FAP-retargeted Ad5 enables in vivo gene delivery to stromal cells in the tumor microenvironment.
[4] Zihan Wang, Jinping Wang, Tianyi Lan, Liubo Zhang, Zeran Yan, N. Zhang, Yuan Xu, Qing-wen Tao.(2023). Role and mechanism of fibroblast-activated protein-α expression on the surface of fibroblast-like synoviocytes in rheumatoid arthritis.
[5] Spencer D. Lindeman, Jack Higgins.(2024). Abstract 6026: A novel lutetium-177 radioligand therapy targeting FAP has potent antitumor activity in xenograft cancer model.
[6] Ruchi Shah, Katherine A. Johnson, Anna E L Lippert, Sean G Kraus, Philip B. Emmerich, Cheri A Pasch, Wei Zhang, K. Matkowskyj, Aaron M LeBeau, D. Deming.(2024). Cancer-Associated Fibroblast Proteins as Potential Targets against Colorectal Cancers.
[7] Mengxin Xu, Pu Zhang, J. Ding, Junyi Chen, L. Huo, Zhibo Liu.(2021). Albumin Binder–Conjugated Fibroblast Activation Protein Inhibitor Radiopharmaceuticals for Cancer Therapy.
[8] Layne N. Raborn, Z. Michel, Michael T. Collins, Alison M Boyce, L. F. de Castro.(2024). Fibroblast Activation Protein Is Expressed by Altered Osteoprogenitors and Associated to Disease Burden in Fibrous Dysplasia.
[9] L. Loureiro, Lydia Hoffmann, Christin Neuber, Luise Rupp, C. Arndt, A. Kegler, M. Kubeil, Christoph E Hagemeyer, Holger Stephan, Marc Schmitz, A. Feldmann, M. Bachmann.(2023). Immunotheranostic target modules for imaging and navigation of UniCAR T-cells to strike FAP-expressing cells and the tumor microenvironment.
[10] Yentl Van Rymenant, Anke de Groot, Laura Dirkx, Emile Verhulst, Joni De Loose, Isabel Pintelon, Tias Verhezen, J. De Waele, Sofie Thys, O. De Wever, Muhammet Tanc, G. Caljon, Pieter Van der Veken, Ingrid De Meester.(2025). FAP on human NK cells: insights from NK cell activation and crosstalk with cancer-associated fibroblasts.
[11] Lirong Gao, Anqi Wang, Yuling Chen, Xin Cai, Yue Li, Jian Zhao, Yang Zhang, Weijie Zhang, Jianjie Zhu, Yuanyuan Zeng, Zeyi Liu, Jianyang Huang.(2023). FTO facilitates cancer metastasis by modifying the m6A level of FAP to induce integrin/FAK signaling in non-small cell lung cancer.
[12] Patrizio Ansalone.(2014). Electrostatic Affinities and Binding Kinetics among α2I Integrin Domains, Divalent Cations and 21-mer Collagen Fragment.
[13] Samuel Bell, Eugene M. Terentjev.(2016). Focal adhesion kinase - the reversible molecular mechanosensor.
[14] Min Li, Xue Cheng, Rong Rong, Yan-ping Gao, Xiuwu Tang, Youguo Chen.(2020). High expression of fibroblast activation protein (FAP) predicts poor outcome in high-grade serous ovarian cancer.
[15] Monika Licaj, R. Mhaidly, Y. Kieffer, H. Croizer, C. Bonneau, A. Meng, L. Djerroudi, Kevin Mujangi-Ebeka, H. Hocine, B. Bourachot, Ilaria Magagna, Renaud Leclère, Léa Guyonnet, Mylène Bohec, Coralie Guérin, S. Baulande, M. Kamal, C. le Tourneau, Fabrice Lécuru, Véronique Becette, Roman Rouzier, A. Vincent-Salomon, Géraldine Gentric, F. Mechta-Grigoriou.(2024). Residual ANTXR1+ myofibroblasts after chemotherapy inhibit anti-tumor immunity via YAP1 signaling pathway.
[16] Q. Ping, Chunhui Wang, Xin Cheng, Yiming Zhong, R. Yan, Meng Yang, Yunqiang Shi, Xiangmeng Li, Xiao Li, Wenwen Huang, Liqiong Wang, Xiaofang Bi, Libing Hu, Yang Yang, Yingbao Wang, R. Gong, Jun Tan, Rui Li, Hui Li, Jian Li, Wenju Wang, Ruhong Li.(2023). TGF-β1 dominates stromal fibroblast-mediated EMT via the FAP/VCAN axis in bladder cancer cells.
[17] Linlin Wang, Dong Yang, Jing Tian, Aiqin Gao, Yihang Shen, X. Ren, Xia Li, G. Jiang, Taotao Dong.(2017). Tumor necrosis factor receptor 2/AKT and ERK signaling pathways contribute to the switch from fibroblasts to CAFs by progranulin in microenvironment of colorectal cancer.
[18] Ruifang Li, Yifan Tai, Xinyan Zhang, Zhen Liu, Haipeng Si, Deling Kong, Lili Zhao, Jia Li, Adam C. Midgley.(2025). Tissue‐Microenvironment‐Responsive Self‐Assembling Peptide Nanoshells Boost Pirfenidone Efficacy in the Treatment of Liver Fibrosis.
[19] Jiawan Wang, Heng Du, Wanrun Xie, Jinmiao Bi, Hao Zhang, Xu Liu, Yuhan Wang, Shaolong Zhang, Anhua Lei, Chuting He, Hailong Yuan, Jiahe Zhang, Yujing Li, Pengfei Xu, Siqi Liu, Yanan Zhou, Jianghua Shen, Jingdong Wu, Yihong Cai, Chaofan Yang, Zeya Li, Y. Liang, Yang Zhao, Jin Zhang, Moshi Song.(2024). CAR-Macrophage Therapy Alleviates Myocardial Ischemia-Reperfusion Injury.
[20] Shipra Das, J. Valton, P. Duchateau, L. Poirot.(2023). Stromal depletion by TALEN-edited universal hypoimmunogenic FAP-CAR T cells enables infiltration and anti-tumor cytotoxicity of tumor antigen-targeted CAR-T immunotherapy.
[21] Tingting You, Huijing Tang, Wenjing Wu, Jin Gao, Xuechun Li, Ningning Li, Xiuxiu Xu, Jiazhang Xing, Hui Ge, Yi Xiao, Junchao Guo, Bin Wu, Xiaoyi Li, Liangrui Zhou, Lin Zhao, C. Bai, Qin Han, Zhao Sun, R. Zhao.(2023). POSTN Secretion by Extracellular Matrix Cancer-Associated Fibroblasts (eCAFs) Correlates with Poor ICB Response via Macrophage Chemotaxis Activation of Akt Signaling Pathway in Gastric Cancer.
[22] Weiqiang Huang, Longshan Zhang, Mi Yang, Xixi Wu, Xiaoqing Wang, Wenqi Huang, Lu Yuan, Hua Pan, Yin Wang, Zici Wang, Yuting Wu, Jihong Huang, Huazhen Liang, Shaoqun Li, Liwei Liao, Laiyu Liu, J. Guan.(2020). Cancer-associated fibroblasts promote the survival of irradiated nasopharyngeal carcinoma cells via the NF-κB pathway.



