武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
GPR20:从“孤儿”到攻克耐药GIST的潜力新靶点
148 人阅读发布时间:2025-11-14 14:22
在肿瘤治疗领域,攻克耐药性始终是研究者们面临的严峻挑战。GPR20,一个长期沉寂的“孤儿”GPCR,正因其在耐药性胃肠道间质瘤(GIST)中的独特表现而崭露头角。本文将带您深入了解GPR20如何从其神秘的“孤儿”身份,一步步成为对抗耐药GIST的潜力新靶点,并揭示其背后的信号机制及靶向药物研发的最近突破,为未来肿瘤治疗带来新的希望。
1. GPR20——一个新兴的G蛋白偶联受体靶点
2. GPR20的背景与初步鉴定
3. GPR20的研究机制与信号通路
4. GPR20与相关疾病:以胃肠道间质瘤(GIST)为例
5. GPR20靶向药物的最近研究进展
6. GPR20研究工具
1. GPR20——一个新兴的G蛋白偶联受体靶点
G蛋白偶联受体(GPCRs)是细胞膜上最大的受体家族,参与多种生理过程并是重要的药物靶点。在这些受体中,大约有140个被称为孤儿GPCRs的成员,其内源性配体尚未被发现,具有巨大的药物开发潜力。GPR20作为一个新兴的A类孤儿GPCR,因其独特的组成型活性和在多种生理病理过程中的潜在作用,逐渐引起了广泛关注 [1]。
研究显示,GPR20通过组成型激活Gi/o蛋白,导致细胞内环磷酸腺苷(cAMP)水平降低,并可能通过调控细胞周期信号抑制细胞增殖。其高基础活性的分子机制已通过冷冻电镜技术解析,发现其独特的N端螺旋帽结构在激活中发挥关键作用,并且正构口袋中未识别的电子密度提示了内源性配体的存在 [1]。
在疾病领域,GPR20被鉴定为胃肠道间质瘤(GIST)的新型非激酶治疗靶点,尤其是在对酪氨酸激酶抑制剂(TKIs)耐药的GIST中表现出差异性高表达 [2]。基于此,靶向GPR20的抗体偶联药物DS-6157a被开发,并在临床前模型中展现出依赖GPR20表达的抗肿瘤活性,对TKI耐药的GIST有效 [2]。
2. GPR20的背景与初步鉴定
GPR20作为孤儿GPCR,最初是通过基因组DNA中的聚合酶链式反应(PCR)被发现的。其序列分析显示与核苷酸或脂质受体有高度同源性,但早期研究尚未明确其内源性配体和生理功能[1]。GPR20的组成型活性使其成为一个有趣的研究对象,即使在没有已知配体的情况下,GPR20仍能持续激活Gi/o蛋白,进而影响cAMP水平 [2]。进一步的研究表明,GPR20通过Gi/o蛋白的激活,抑制了腺苷酸环化酶(AC)的活性,从而降低了cAMP水平,进而可能影响细胞增殖和其他生理功能 [2]。
3. GPR20的研究机制与信号通路
GPR20具有显著的组成型活性,即在没有已知配体的情况下也能激活偶联的G蛋白。这一特性使其在细胞生理中扮演了独特角色。本章将深入探讨GPR20如何通过Gi/o蛋白途径调控下游信号,尤其是其对cAMP水平的抑制作用及其对细胞增殖的影响 [2]。
3.1 GPR20的组成型活性与Gi/o蛋白偶联
GPR20的组成型活性在多种细胞系中均得到了验证。例如,在HEK293细胞中,GPR20过表达会显著降低cAMP水平,同时增加GTPγS的结合量,这表明GPR20能够自发激活Gi/o蛋白 [2]。这一机制可以通过百日咳毒素(PTX)抑制,进一步证实了Gi/o蛋白在其作用中的关键角色。实验还发现,GPR20中的DRY基序对于G蛋白的激活至关重要 [2]。
3.2 GPR20的结构生物学解析
最近,通过低温电子显微镜(cryo-EM)技术,研究人员成功解析了GPR20与Gi蛋白复合体的结构,揭示了其组成型活性背后的分子机制 [1]。其中,GPR20独特的N端螺旋帽结构稳定了其活化构象,使得GPR20能够在没有配体的情况下持续激活Gi/o蛋白 [1]。此外,结构分析还揭示了GPR20的正构口袋中未分配的电子密度,提示可能存在内源性配体或重要的调控分子 [1]。
3.3 GPR20的细胞功能与配体探索
GPR20的组成型激活影响细胞内cAMP水平及有丝分裂信号,抑制细胞增殖。研究还发现,GPR20的高基础活性可能是其在细胞生理中发挥作用的关键。进一步探索其内源性配体的身份,将为理解GPR20的生物学功能提供重要线索 [1]。
4. GPR20与相关疾病:以胃肠道间质瘤(GIST)为例
胃肠道间质瘤(GIST)是胃肠道最常见的间充质肿瘤,治疗上主要依赖酪氨酸激酶抑制剂(TKIs)。然而,TKI耐药性是导致GIST治疗失败的主要原因之一。因此,寻找新的靶点对克服TKI耐药具有重要意义 [3]。
4.1 GPR20在GIST中的作用
GPR20在GIST中的高表达使其成为一个潜在的治疗靶点。研究表明,在GIST细胞系和患者来源异种移植(PDX)模型中,GPR20的表达显著增加 [3]。基于这一发现,研究者开发了靶向GPR20的抗体药物偶联物(ADC)DS-6157a,该药物在临床前模型中表现出依赖GPR20表达的抗肿瘤活性,对TKI耐药的GIST有效 [3]。
4.2 GPR20在GIST中的临床前研究
DS-6157a的临床前研究表明,该药物在多种GIST模型中具有显著的抗肿瘤活性,尤其对伊马替尼、舒尼替尼和瑞戈非尼耐药的GIST模型展现出优异效果 [3]。此外,DS-6157a的药代动力学特性也已在早期临床研究中得到了初步评估 [4]。
5. GPR20靶向药物的最近研究进展
DS-6157a代表了靶向GPR20的首各抗体药物偶联物(ADC),其设计旨在克服GIST对TKI治疗的耐药性。该药物由抗GPR20抗体、可酶切连接子和拓扑异构酶I抑制剂载荷DXd组成,能够在GIST异种移植模型中依赖GPR20表达发挥抗肿瘤作用 [3]。
DS-6157a的临床前评估显示其对TKI耐药的GIST模型具有显著抗肿瘤活性。此外,早期临床试验表明,DS-6157a的药代动力学特性与安全性之间存在明显的关系,药物暴露量与中性粒细胞减少症和血小板减少症等血液学不良事件相关 [4]。
6. GPR20研究工具
GPR20作为孤儿GPCR,其组成型活性及在GIST等疾病中的潜力,推动了针对该受体的靶向治疗研究。尽管目前的研究仍在早期阶段,但DS-6157a等新型药物已展示了GPR20作为治疗靶点的巨大潜力。华美生物提供GPR20重组蛋白、抗体产品,助力您进一步探索GPR20的内源性配体及其在更多疾病中的作用,推动GPR20靶向疗法的临床应用。
● GPR20重组蛋白
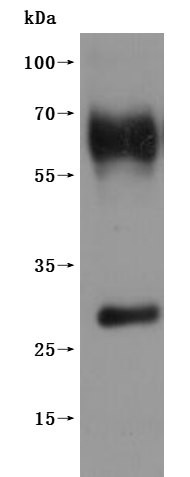
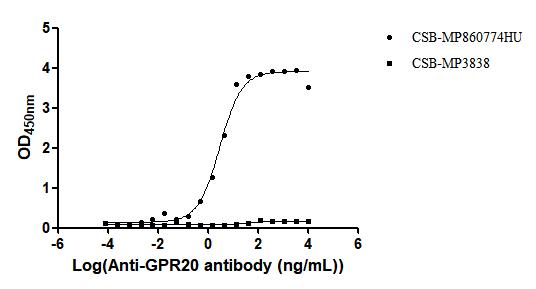
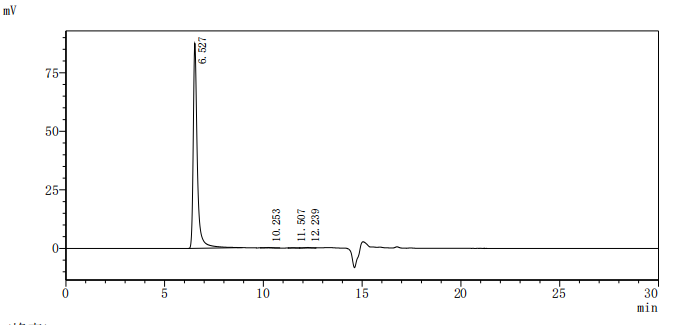
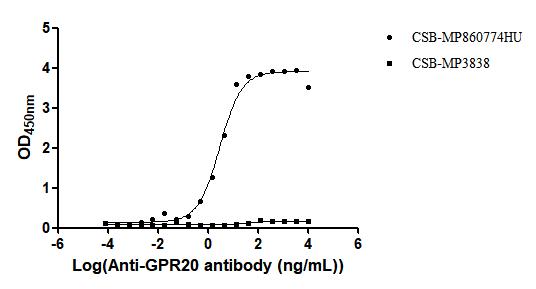
Recombinant Human G-protein coupled receptor 20 (GPR20)-VLPs (Active); CSB-MP860774HU
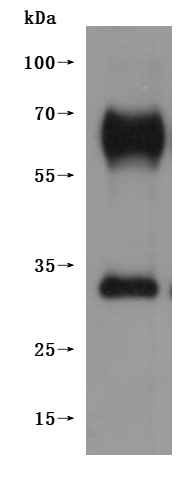
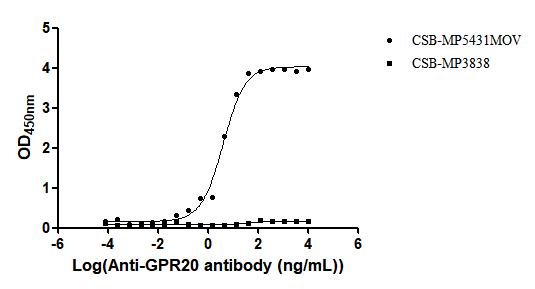
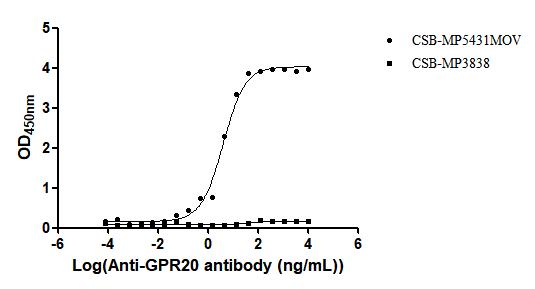
Recombinant Macaca fascicularis G protein-coupled receptor 20 (GPR20)-VLPs (Active); CSB-MP5431MOV
● GPR20抗体
GPR20 Recombinant Monoclonal Antibody; CSB-RA860774MA1HU
参考文献:
[1] Xi Lin, Shan Jiang, Yiran Wu, Xiaohu Wei, G. Han, Lijie Wu, Junlin Liu, Bo Chen, Zhibin Zhang, Suwen Zhao, V. Cherezov, Fei Xu.(2023). The activation mechanism and antibody binding mode for orphan GPR20.
[2] Momoko Hase, T. Yokomizo, Takao Shimizu, Motonao Nakamura.(2008). Characterization of an Orphan G Protein-coupled Receptor, GPR20, That Constitutively Activates Gi Proteins*.
[3] K. Iida, A. A. Abdelhamid Ahmed, A. Nagatsuma, T. Shibutani, Satoru Yasuda, Michiko Kitamura, C. Hattori, Manabu Abe, J. Hasegawa, Takuma Iguchi, Tsuyoshi Karibe, T. Nakada, K. Inaki, Reiko Kamei, Yuki Abe, T. Nomura, J. Andersen, S. Santagata, Matthew L. Hemming, S. George, T. Doi, A. Ochiai, G. Demetri, T. Agatsuma.(2021). Identification and Therapeutic Targeting of GPR20, Selectively Expressed in Gastrointestinal Stromal Tumors, with DS-6157a, a First-In-Class Antibody-Drug Conjugate.
[4] Brittany P Tran, Maura Fallon, Kristin Follman, Sergio Iadevaia, Madan Kundu, A. Laadem, Yvonne Lau, Satoshi Nishioka, Julia Shi, Xinyuan Zhang. Population pharmacokinetics and exposure-safety of DS-6157a in patients with advanced gastrointestinal stromal tumor (GIST).



