武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
靶向EphA2:对抗肿瘤耐药与转移的新焦点
273 人阅读发布时间:2025-11-14 13:25
肿瘤的耐药与转移,是导致癌症治疗失败与患者死亡的主要原因。面对这一临床困境,科学家们将目光投向了癌细胞上一个关键的“信号枢纽”——EphA2受体。
大量研究表明,EphA2不仅在多种癌症中高表达,更在驱动耐药形成、促进侵袭转移中扮演着核心角色。本文将深入解析EphA2独特的双重信号机制,阐述其如何成为肿瘤恶化的“帮凶”,并盘点围绕它展开的全新靶向治疗策略,为您揭示这一充满潜力的抗癌新焦点。
1. EphA2受体酪氨酸激酶的研究背景
2. EphA2的分子背景、结构与基本功能
3. EphA2的信号通路与研究机制
4. EphA2在相关疾病中的作用
5. EphA2靶向药物与治疗策略进展
6. EphA2研究工具
1. EphA2受体酪氨酸激酶的研究背景
EphA2(Erythropoietin-producing human hepatocellular receptor A2)是Eph受体酪氨酸激酶(RTK)家族的重要成员,该家族是已知最大的RTK亚型,在细胞通讯、发育、形态建成、迁移及黏附中发挥核心作用 [1,2]。EphA2的激活依赖于配体结合,能够形成不同构象的寡聚体,引发多样化信号反应 [3],因此在生理与病理状态下均具有广泛影响。
大量研究证实,EphA2在多种恶性肿瘤中高表达,并与肿瘤侵袭性、转移及不良预后密切相关 [4-6]。在三阴性乳腺癌中,EphA2高表达与较差生存率显著相关,其基因沉默可抑制细胞增殖与侵袭 [4]。类似的促癌效应也出现在结直肠癌 [5]、胃癌 [7]、卵巢癌 [8]、非小细胞肺癌 [9]等。EphA2可促进肿瘤细胞增殖、上皮-间充质转化(EMT)[10]、血管生成 [7,11]、转移及耐药形成 [12,13]。此外,外泌体EphA2能在细胞间转移耐药性,进一步加剧肿瘤恶性进程 [12]。
EphA2信号具有典型的“双重功能”,即配体依赖性(经典)与配体非依赖性(非经典)模式。经典信号多表现为抑癌作用,例如ephrinA1-EphA2结合可通过Ezrin磷酸化调控肌动蛋白骨架,促进细胞极化与黏附 [1,2];而在缺乏配体的肿瘤环境中,EphA2常通过Ser897位点的磷酸化形成非经典信号,呈现促癌特征 [14-16]。例如,前列腺癌中雄激素受体(AR)抑制作用的缺失会导致EphA2过表达,并经非经典信号驱动去势抵抗 [6,15]。除肿瘤外,EphA2亦参与炎症与免疫过程,如LPS诱导的肺损伤 [17]及鼻黏膜抗病毒反应 [18,19]。
因此,EphA2因其在多种疾病中的关键作用及信号复杂性,成为具有挑战性的潜在治疗靶点 [20,21]。目前针对EphA2的小分子抑制剂、单克隆抗体、ADC药物及纳米递送系统均在积极研发中 [22,23],如抑制剂ALW-II-41-27能抑制宫颈癌生长并逆转结直肠癌耐药 [5,24]。此外,EphA2与PARP或HDAC抑制剂联合治疗在卵巢癌中展现协同效应 [25,26]。因此,深入理解EphA2信号通路对于靶向治疗开发与耐药机制研究具有重要意义。
2. EphA2的分子背景、结构与基本功能
2.1 Eph受体家族与ephrin配体概述
Eph受体酪氨酸激酶(Eph RTK)家族是介导细胞间通讯的重要分子网络,依据序列同源性与配体特异性分为EphA与EphB两类。EphA受体主要结合GPI锚定型ephrinA配体,EphB受体则与跨膜型ephrinB结合 [8]。与其他RTK不同,Eph/ephrin信号依赖细胞间直接接触,其激活需跨膜形成受体-配体复合物 [27]。这种结构特征使EphA2在细胞识别、迁移和形态变化中发挥关键作用。例如,EphA2与ephrinA1结合能调节细胞黏附与排斥反应 [1,2],在发育与肿瘤生长中均有重要意义。不同ephrin配体(如EFNA1与EFNA5)在疾病背景中可能具有相反效应 [8],体现了Eph/ephrin信号的高度情境依赖性。
2.2 EphA2结构特点与表达模式
EphA2结构包括胞外配体结合域、跨膜区与胞内酪氨酸激酶域。胞外域负责识别EphrinA配体,胞内域含近膜区、激酶结构域及PDZ结合基序,用以募集下游信号复合物 [3]。其激活常伴随受体二聚化与自磷酸化。研究表明,膜胆固醇降低可促进EphA2自组装及Ser897磷酸化,增强其促癌信号 [28]。
EphA2在正常组织中广泛表达,如血管平滑肌细胞和鼻窦黏膜 [19,29]。但在多种恶性肿瘤中,其高表达是典型特征,与侵袭、转移及预后不良密切相关 [20,31]。例如,在TNBC中EphA2促进细胞增殖和骨转移 [32];在胰腺癌中,其过表达增强药物递送效率并提高吉西他滨疗效 [33]。此外,EphA2的高表达与鼻咽癌放疗抵抗 [34]、前列腺癌去势抵抗 [15]、胃癌B3GNT3上调 [35]及肝癌CD90阳性细胞迁移 [36] 均密切相关。EFNA5的过表达也与卵巢癌患者生存期缩短相关 [8]。因此,EphA2不仅是致癌信号枢纽,也是潜在生物标志物与治疗靶点。
2.3 经典与非经典信号传导模式
EphA2信号具有两种主要模式:配体依赖性(经典)与配体非依赖性(非经典)通路。
经典信号由ephrinA1结合触发,通过受体寡聚化和酪氨酸残基自磷酸化激活下游通路 [37]。例如,EphA2在血管平滑肌细胞中与ephrinA1结合可抑制ERK1/2与AKT活性,从而抑制细胞迁移 [29]。外泌体EphA2在内皮细胞中经EphrinA1依赖通路激活AMPK信号,促进血管生成 [11]。
非经典信号则在缺乏配体时被激活,典型标志为Ser897磷酸化 [14]。例如,在前列腺癌中,EphA2 S897磷酸化促进去势抵抗与侵袭 [6,15];在血管平滑肌细胞中,该位点磷酸化可增强迁移 [29]。MK2-RSK信号轴被认为是EphA2非经典激活的重要上游调节因子 [14]。此外,EphA2可被MT1-MMP裂解为促癌性EphA2-NF片段,成为潜在肿瘤标志物 [39]。因此,经典信号常表现抑癌效应,而非经典信号多与肿瘤进展相关。
3. EphA2的信号通路与研究机制
EphA2信号网络复杂,涉及多条细胞内通路的交叉调控,尤其是PI3K/AKT、MAPK/ERK、Rho GTPase及Src家族通路。其激活方式(配体依赖或非依赖)直接影响这些下游信号的方向与强度。
3.1 配体依赖的经典信号通路
配体结合诱导EphA2二聚化与酪氨酸自磷酸化,形成经典前向信号 [3]。EphA2-ephrinA1信号可通过Ezrin-RhoA通路调节细胞骨架与极性 [1];通过Src-FAK-paxillin轴调控细胞黏附与迁移 [27];并在血管平滑肌细胞中抑制ERK/AKT信号,阻止病理性增殖 [29]。此外,EphA2激活后还可诱导配体ephrin-A反向信号,如外泌体EphA2通过EphrinA1激活ERK1/2或AMPK通路,促进肿瘤侵袭与血管生成 [11,12]。这表明经典信号具有双向性,既维持细胞稳态,也在特定背景下调节肿瘤进展。
3.2 配体非依赖的非经典信号通路
在缺乏配体或特定应激下,EphA2通过Ser897或Tyr772位点磷酸化形成非经典激活模式 [14-16]。Ser897磷酸化由RSK介导,并在前列腺癌、肝癌及血管平滑肌细胞中增强迁移和侵袭 [15,29,36];化疗药物如顺铂亦可通过ERK-RSK-EphA2通路诱导S897磷酸化,导致卵巢癌耐药 [40]。Y772位点磷酸化则激活Shp2/ERK1/2信号,驱动鼻咽癌细胞增殖 [16]。此外,MT1-MMP裂解、胆固醇降低及SNAI1-PIK3R2相互作用均可促进EphA2非经典信号活化 [10,28,39]。这些机制共同塑造了EphA2在肿瘤中的促迁移、促侵袭及耐药特性。
3.3 与主要信号通路的交互调控
EphA2与PI3K/AKT通路广泛交联,常通过上调AKT信号促进细胞存活与迁移 [7,13,35,41,42]。在胃癌与乳腺癌中,EphA2激活PI3K/AKT通路促进恶性进展 [4,35];而在PTEN缺失背景下,Src激活亦可上调EphA2表达 [45]。
MAPK/ERK通路是另一核心轴,EphA2 S897磷酸化常依赖ERK-RSK信号 [14,46],其抑制可恢复化疗敏感性 [40]。
此外,EphA2调节Rho GTPase家族以控制细胞骨架重塑 [1,24];与Src激酶协同调节粘着斑动态 [27,45];并可通过Wnt/β-catenin通路驱动EMT与干性维持 [10,44]。
这些复杂的信号交互构成了EphA2作为“信号枢纽”的生物学基础,也为靶向治疗提供了多层干预节点。
4. EphA2在相关疾病中的作用
EphA2受体酪氨酸激酶作为细胞信号传导的关键分子,在多种病理过程中具有广泛影响。本章重点概述其在肿瘤发生发展、心血管疾病及炎症反应中的功能机制,强调EphA2信号通路在疾病演进和治疗中的多重角色。
4.1 EphA2在肿瘤发生发展中的作用
EphA2在多种实体瘤中表现出促癌作用,通过调控细胞增殖、迁移、侵袭、EMT转化、血管生成及耐药性形成,驱动肿瘤恶化。以下选取几种研究最深入的癌症类型进行概述。
4.1.1 前列腺癌与去势抵抗
在前列腺癌(PCa)中,EphA2高表达与去势抵抗性进展密切相关 [6]。其S897位点的非经典磷酸化可激活致癌信号,促进细胞迁移、侵袭及去分化 [6,15]。磷酸化蛋白质组学研究揭示,EphA2激活可引发PI3K/AKT/mTOR及ERK/MAPK通路广泛改变,涉及细胞骨架重塑、运动与连接调节 [38]。尽管EphA2具有促癌与抑癌双重潜能,但在CRPC背景下,其非经典信号明显偏向促癌方向。SHB与afadin等衔接蛋白进一步调节EphA2-ERK通路,增强细胞迁移与侵袭能力 [38]。因此,阻断EphA2非经典信号被认为是延缓PCa进展的潜在策略。
4.1.2 胰腺癌与早期诊断潜力
EphA2在胰腺导管腺癌(PDC)中过表达,是早期诊断与药物递送的潜在靶点 [33]。研究显示,EphA2靶向吉西他滨偶联药物在肿瘤组织中富集度更高,能提高疗效并减少毒性 [33]。值得关注的是,基质金属蛋白酶MT1-MMP可裂解EphA2胞外N端,生成促癌片段EphA2-NF [39]。血清EphA2-NF水平在PDC患者中显著升高,包括早期病例,与EphA2缺失的组织学特征一致 [39]。因此,EphA2-NF可作为一种无创生物标志物,为PDC早期检测与风险评估提供新思路。
4.1.3 结直肠癌与耐药机制
在结直肠癌(CRC)中,EphA2高表达与EGFR靶向药物西妥昔单抗(Cetuximab)耐药密切相关 [5]。EphA2激活能触发替代性生存信号,削弱抗EGFR疗效。EphA2抑制剂ALW-II-41-27与西妥昔单抗联合可逆转耐药,抑制肿瘤生长并诱导细胞凋亡 [5]。临床分析亦发现EphA2高表达患者的无进展生存期显著缩短。另一方面,CEACAM1-L通过下调EphA2及STAT3信号抑制CRC肝转移 [30],提示EphA2调控肿瘤转移具有情境依赖性。深入解析EphA2与CEACAM家族的交互作用,将有助于开发克服耐药的新策略。
4.1.4 卵巢癌与化疗敏感性调控
高级别浆液性卵巢癌(HGSOC)常因化疗耐药导致复发。研究显示,EphA2与FAK共同调控PI3K/AKT和MAPK/ERK信号,是药物敏感性的重要决定因子 [25]。Brigatinib作为双重抑制剂,可协同PARP抑制剂(PARPi)增强凋亡,改善治疗反应 [25]。此外,铂类化疗可诱导ERK1/2-RSK1/2-EphA2-GPRC5A信号开关,引发适应性耐药 [40]。RSK抑制剂能阻止EphA2 S897磷酸化并恢复铂敏感性 [40]。该发现揭示EphA2在化疗耐药形成中的核心地位,也为联合靶向RSK-EphA2通路提供了新方向。
4.1.5 乳腺癌与外泌体信号调控
EphA2在三阴性乳腺癌(TNBC)中高表达,与侵袭性及预后不良密切相关 [31]。EPA与EphA2抑制剂联合能通过扰乱胆固醇稳态、抑制ABCA1表达,显著增强细胞凋亡 [31]。此外,高转移性乳腺癌细胞释放的外泌体EphA2可激活内皮细胞AMPK信号,促进血管生成与转移 [11]。这表明EphA2不仅作为肿瘤内信号分子,也通过外泌体介导细胞间通讯,成为肿瘤微环境重塑的重要因子。
4.2 EphA2在心血管与炎症性疾病中的作用
除肿瘤外,EphA2在心血管与炎症疾病中亦发挥调节作用。研究发现,EphA2与ephrinA1在血管平滑肌细胞中共同维持血管稳态,其配体结合可抑制VSMC迁移与增殖 [29]。高同型半胱氨酸血症患者中,EphA2-PI3K/AKT/NF-κB信号被异常激活,导致内皮屏障功能受损 [43]。在肺部炎症模型中,EphA2调控LPS诱导的细胞因子释放及屏障完整性 [17]。此外,EphA2在鼻窦黏膜中参与抗病毒免疫反应,通过调控上皮细胞分泌与屏障稳定性影响慢性鼻炎病程 [18,19]。这些研究拓展了EphA2的功能边界,显示其在免疫与血管生物学中的重要作用。
5. EphA2靶向药物与治疗策略进展
EphA2因其在多种疾病中的关键作用,成为新兴的靶向治疗焦点。当前的药物研究主要集中在小分子抑制剂、抗体药物偶联物(ADC)、核酸干预及纳米递送系统等方向。部分在研管线如下表:
| 药物 | 药物类型 | 在研适应症(疾病名) | 在研机构 | 最高研发阶段 |
|---|---|---|---|---|
| 瑞戈非尼 | 小分子化药 | 肝癌 | 肝细胞癌 | 结直肠癌 | 胃肠道间质瘤 | 转移性结直肠癌等 | Bayer AG | Bristol Myers Squibb Co. | Bayer Yakuhin Ltd. | Merck KGaA | Bayer Pharma AG等 | 批准上市 |
| 达沙替尼 | 小分子化药 | 加速期慢性骨髄性白血病 | 慢性期费城染色体阳性慢性粒细胞白血病 等 | Bristol Myers Squibb Co. | Accord Healthcare SLU | Bristol-Myers Squibb Pharma EEIG等 | 批准上市 |
| Dasatinib monolauryl sulfate | 小分子化药 | 肿瘤 | 汉达生技医药股份有限公司 | 申请上市 |
| Nuzefatide pevedotin | 多肽偶联药物(PDC) | 晚期恶性实体瘤 | 非小细胞肺癌 | 卵巢癌 | 头颈部鳞状细胞癌等 | Bicycle Therapeutics Plc | 临床1/2期 |
| TP53-EphA-2-CAR-DC vaccine(Chinese PLA General Hospital) | CAR-DC | - | 浙江大学 | 中国人民解放军总医院 | 临床1期 |
| Dasatinib nanoparticle formulation(Xspray Pharma AB) | 小分子化药 | 费城染色体阳性慢性粒细胞白血病 | Xspray Pharma AB | 临床1期 |
| E-SYNC T Cells(University of California) | CAR-T | EGFR突变胶质母细胞瘤 | 复发性胶质母细胞瘤 | The University of California, San Francisco | 临床1期 |
| EphA2-targeted CAR-DC(Second Affiliated Hospital, School of Medicine, Zhejiang University) | CAR-DC | 转移性非小细胞肺癌 | 浙江大学医学院附属第二医院(浙江省第二医院) | 临床1期 |
| P30-EPS vaccine(Duke University) | 合成肽疫苗 | 治疗性疫苗 | 多形性胶质母细胞瘤 | Duke University | 临床1期 |
| SC-102 | 多肽偶联药物(PDC) | 转移性实体瘤 | 晚期恶性实体瘤 | 按部位分类的实体瘤 | 天津星联肽生物科技有限公司 | 临床1期 |
| siRNA-EphA2-DOPC | siRNA | 卵巢癌 | 胰腺癌 | The University of Texas MD Anderson Cancer Center | 临床1期 |
| MB-108 | 溶瘤病毒 | 多形性胶质母细胞瘤 | 神经胶质肉瘤 | 复发性恶性胶质瘤 | 胶质母细胞瘤 | The University of Alabama at Birmingham | Nationwide Children's Hospital | Mustang Bio, Inc. | 临床1期 |
| EphA2-targeted CAR-T Cell(Second Affiliated Hospital, School of Medicine, Zhejiang University) | CAR-T | 转移性非小细胞肺癌 | 浙江大学医学院附属第二医院(浙江省第二医院) | 临床1期 |
(数据截止到2025年11月4日,来源于synapse)
6. EphA2研究工具
EphA2受体酪氨酸激酶作为信号转导枢纽,在多种肿瘤及炎症疾病中展现双重功能。华美生物提供EphA2研究相关重组蛋白、抗体、ELISA试剂盒,助力您关于EphA2信号双向调控的分子机制研究,或EphA2靶向药物开发。
● EphA2重组蛋白
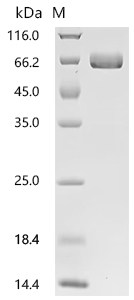
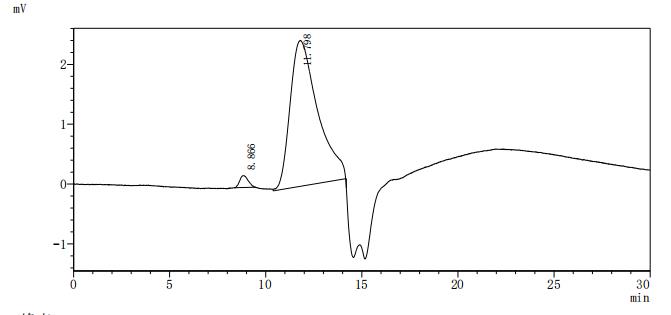
Recombinant Human Ephrin type-A receptor 2 (EPHA2F), partial (Active); CSB-MP007722HUd7
● EphA2抗体
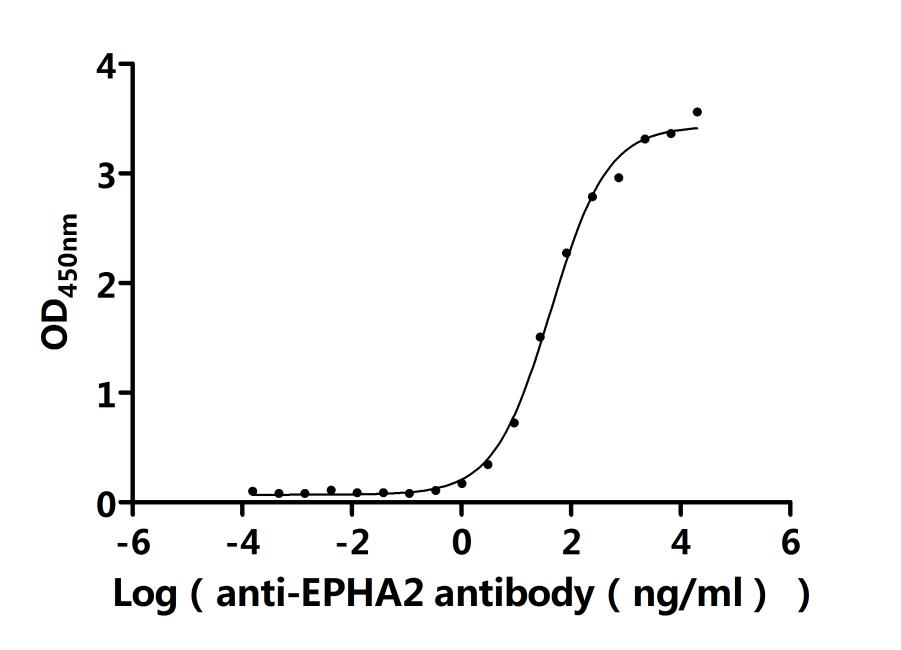
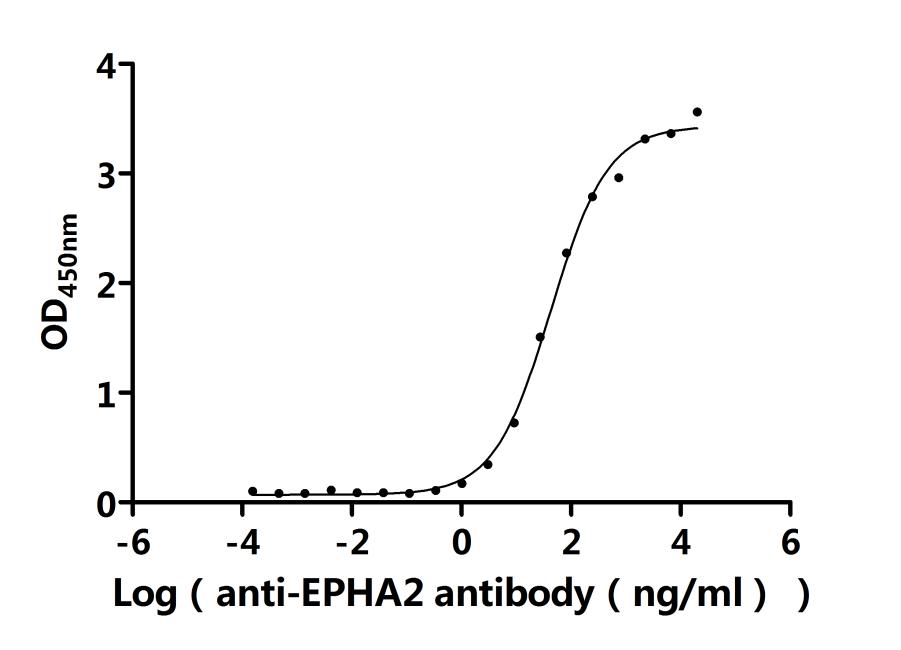
EPHA2 Recombinant Monoclonal Antibody; CSB-RA007722MA1HU
● EphA2 ELISA试剂盒
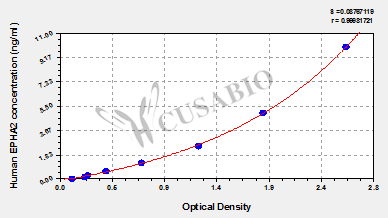
Human Ephrin type-A receptor 2(EPHA2) ELISA kit; CSB-EL007722HU
● EphA2稳转细胞株
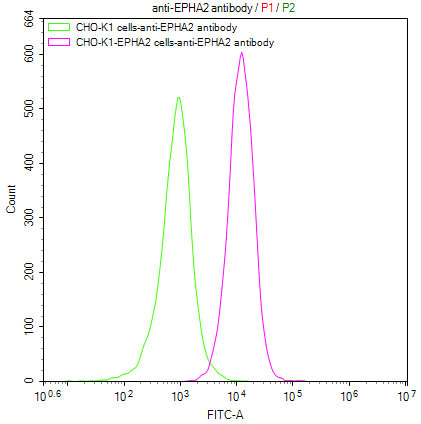
CHOK1/Human EphA2(207-976) Stable Cell Line; CSB-SC007722HU1
参考文献:
[1] Yuki Wakayama, K. Miura, H. Sabe, N. Mochizuki.(2011). EphrinA1-EphA2 Signal Induces Compaction and Polarization of Madin-Darby Canine Kidney Cells by Inactivating Ezrin through Negative Regulation of RhoA.
[2] M. Parri, F. Buricchi, M. Taddei, E. Giannoni, G. Raugei, G. Ramponi, P. Chiarugi.(2005). EphrinA1 Repulsive Response Is Regulated by an EphA2 Tyrosine Phosphatase.
[3] Deo R. Singh, Pranjali P Kanvinde, Christopher King, E. Pasquale, K. Hristova.(2018). The EphA2 receptor is activated through induction of distinct, ligand-dependent oligomeric structures.
[4] Xiaoying Huang, Li Na, Qing Han, Qilun Liu, Ligang Wu.(2025). EPHA2 promotes triple-negative breast cancer progression by suppressing pyroptosis via the AKT/PI3K/mTOR pathway.
[5] G. Martini, C. Cardone, P. Vitiello, V. Belli, S. Napolitano, T. Troiani, D. Ciardiello, C. D. Della Corte, F. Morgillo, N. Matrone, V. Sforza, G. Papaccio, V. Desiderio, M. Paul, V. Moreno‐Viedma, N. Normanno, A. Rachiglio, V. Tirino, E. Maiello, T. Latiano, D. Rizzi, G. Signoriello, M. Sibilia, F. Ciardiello, E. Martinelli.(2019). EPHA2 Is a Predictive Biomarker of Resistance and a Potential Therapeutic Target for Improving Antiepidermal Growth Factor Receptor Therapy in Colorectal Cancer.
[6] Ryan Lingerak, A. Petty, Hong Guo, Hebei Lin, Xiaojun Shi, Soyeon Kim, Bingcheng Wang.(2024). Abstract 1680: Roles of EphA2 receptor signaling in prostate cancer development and progression.
[7] Hee-sung Kim, Y. Won, J. Shim, Hyun Ji Kim, B. Kim, H. Hong.(2019). Role of EphA2-PI3K signaling in vasculogenic mimicry induced by cancer-associated fibroblasts in gastric cancer cells.
[8] J. Jukonen, L. Moyano-Galceran, K. Höpfner, E. Pietilä, Laura Lehtinen, K. Huhtinen, E. G



