武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
PTPRD:从神经发育到癌症抑制,被忽视的信号枢纽
407 人阅读发布时间:2025-10-27 09:39
蛋白酪氨酸磷酸酶受体D型(Protein tyrosine phosphatase receptor type D, PTPRD)是蛋白酪氨酸磷酸酶(PTP)家族的重要成员,属于具有跨膜结构的受体型磷酸酶,通过去磷酸化下游底物蛋白,精准调控细胞内多种信号转导过程。”
PTPRD在机体生理状态下参与神经发育、细胞粘附维持等关键生理过程,同时在肿瘤抑制中发挥核心作用。近年来研究表明,PTPRD的异常表达或功能缺失与癌症、代谢性疾病及神经系统疾病等多种疾病的发生发展密切相关。本文系统梳理了PTPRD的分子结构特征、生理功能,深入剖析其通过不同信号通路调控疾病的分子机制,并总结其在各类疾病中的作用及潜在治疗价值,旨在为以 PTPRD 为靶点的疾病诊断与治疗研究提供参考。
1. PTPRD概述:结构、表达与核心生理功能
2. PTPRD调控的核心信号通路与分子机制
3. PTPRD与疾病治疗:从癌症到代谢及神经疾病
4. 靶向PTPRD:药物研发与治疗新策略
5. 华美生物PTPRD研究相关产品推荐
1. PTPRD概述:结构、表达与核心生理功能
1.1 PTPRD的分子结构特征与分类
PTPRD隶属于蛋白酪氨酸磷酸酶(PTP)家族,该家族共包含107个成员,根据结构特征可分为受体型和非受体型两类。其中,受体型PTPs拥有单一跨膜结构域及与细胞粘附相关的可变胞外域,胞内部分则包含两个串联的PTP结构域(D1 和D2)[3]。PTPRD作为受体型PTPs中白细胞共同抗原相关蛋白(LAR)亚家族的成员,与PTPRF、PTPRS共同构成该亚家族的人类成员 [1]。
从结构上看,PTPRD包含三个关键部分:一是胞外区,含有3个免疫球蛋白样(Ig-like)结构域和8个III型纤连蛋白样(fibronectin type III-like)结构域,这类结构赋予其类似细胞粘附分子的功能,可参与细胞间相互作用 [1,3] ;二是单一跨膜区,负责将蛋白质锚定于细胞膜上;三是胞内区,包含两个串联的催化结构域(D1和D2),D1是介导胞质蛋白磷酸酶活性的核心区域;D2虽与磷酸酶具有序列同源性,但酶活性极低,主要起调控作用,可下调D1的磷酸酶活性。[1] 。
1.2 PTPRD的组织分布与表达特征
PTPRD的表达具有一定组织特异性,通过对人类RNA测序数据的分析发现,其在大脑中表达水平最高(RPKM 值为 18.0),肾脏中次之(RPKM 值为 8.8),同时在结肠、乳腺等其他14种组织中也有不同程度的表达 [1,3]。在神经系统中,PTPRD的表达对神经发育至关重要,例如其可与SLIT-和NTRK样(SLITRK)蛋白结合,促进囊泡型γ- 氨基_丁_酸_(GABA)转运体的积累,而该转运体是突触特化的标志分子,表明PTPRD在神经元细胞粘附中可作为配体发挥作用 [1]。
1.3 PTPRD的核心生理功能:从神经发育到代谢调控
在生理状态下,PTPRD的功能广泛且关键。在细胞层面,其通过调控细胞信号转导参与细胞增殖、分化、迁移及凋亡等多种细胞过程 [3]。在组织器官层面,除神经系统发育外,PTPRD在肝脏代谢调控中也发挥作用,例如在胎儿肝脏中,PTPRD可参与葡萄糖代谢、氨基酸降解等通路的调节,维持胎儿肝脏的正常代谢稳态 [8]。此外,PTPRD还与细胞粘附功能密切相关,通过与E-钙粘蛋白(E-cadherin)、β-连环蛋白(β-catenin)等细胞粘附分子相互作用,维持细胞间连接的稳定性,进而调控上皮细胞间的接触 [1,3]。
1.4 PTPRD异常表达与疾病的关联
近年来大量研究证实,PTPRD的异常表达或功能缺失与多种疾病的发生发展密切相关。在癌症领域,PTPRD常因遗传突变、缺失、拷贝数减少或表观遗传修饰(如启动子高甲基化)而失活,在肝癌、胃癌、胶质母细胞瘤、乳腺癌等多种恶性肿瘤中均观察到PTPRD的表达下调或功能丧失,提示其作为抑癌基因的潜在角色 [1,2,4,6]。在代谢性疾病中,PTPRD的表观遗传沉默可导致胰岛素受体信号通路受损,进而引发胰岛素抵抗,与2型糖尿病的发生密切相关 [3,5]。在神经系统疾病中,PTPRD基因敲除可能导致认知障碍,还可能引发听力丧失、对糖尿病的低敏感性及高血压风险增加等问题,表明其对神经系统、内分泌系统及心血管系统的正常功能维持具有重要意义 [1]。
2. B7-H6与疾病
2. PTPRD调控的核心信号通路与分子机制
PTPRD通过调控多条关键信号通路参与机体的生理和病理过程,这些通路相互关联、相互作用,共同构成了PTPRD的信号调控网络。
2.1 STAT3通路:PTPRD在癌症中的关键作用靶点
STAT3信号通路是PTPRD调控的核心通路之一,在癌症、炎症等多种病理过程中发挥关键作用 [1,3,6]。STAT3作为一种细胞质转录因子,可被细胞因子(如IL-6)、生长因子等外界刺激激活。PTPRD对STAT3信号通路的调控主要通过负反馈方式实现。PTPRD可直接与STAT3相互作用,通过其D1结构域对STAT3的Y705位点进行去磷酸化,抑制STAT3的二聚化和核转位过程,进而阻断其下游靶基因的表达 [1,3]。在肝癌中,PTPRD的失活导致STAT3持续磷酸化,激活MMP-2、MMP-9等靶基因,促进肿瘤细胞增殖和侵袭 [1];在胶质母细胞瘤中,PTPRD缺失使STAT3异常激活,维持肿瘤干细胞的特性并增强肿瘤的恶性表型 [6];在胃癌中,PTPRD通过抑制STAT3激活,下调CXCL8的表达,进而抑制肿瘤血管生成 [2]。此外,在非酒精性脂肪肝疾病中,PTPRD可减弱STAT3(Tyr 705)的磷酸化,参与疾病的发生发展 [1]。
2.2 胰岛素受体通路:PTPRD如何调控糖代谢与糖尿病
胰岛素受体信号通路是调节葡萄糖代谢的关键通路,PTPRD通过对该通路的调控维持机体的代谢稳态 [3,5]。一方面,PTPRD可直接增强胰岛素受体的磷酸化水平,促进胰岛素信号的起始和传递 [3];另一方面,PTPRD可通过激活PPARγ2间接调控该通路,PPARγ2作为一种核受体,可激活胰岛素敏感性相关基因的表达,增强细胞对胰岛素的反应 [5]。当PTPRD因DNA高甲基化而沉默时,其对胰岛素受体磷酸化的促进作用减弱,同时 PPARγ2 的激活不足,导致胰岛素受体信号通路受损,细胞对胰岛素的敏感性下降,出现胰岛素抵抗,最终引发2型糖尿病 [5]。在宫内生长受限的胎儿肝脏中,PTPRD的表达下调也会影响胰岛素受体信号通路的正常功能,导致胎儿肝脏葡萄糖代谢紊乱 [8]。
2.3 NF-κB通路:PTPRD对炎症与肿瘤的负向调控
NF-κB信号通路是调控炎症反应和肿瘤进展的重要通路,PTPRD通过负调控该通路抑制炎症和肿瘤的发生发展 [6,7]。首先,PTPRD可直接与IKK复合物相互作用,抑制IKK的活性,进而减少IκB的磷酸化和降解,维持NF-κB的失活状态 [6];其次,PTPRD可通过调控STAT3信号通路间接影响NF-κB活性,STAT3可与NF-κB相互作用,协同激活下游基因,PTPRD通过抑制STAT3激活,间接减弱NF-κB的转录活性 [6];此外,PTPRD还可通过调节炎症因子(如 IL-6)的表达,影响NF-κB信号通路的激活,IL-6可通过激活JAK/STAT3通路间接激活NF-κB,PTPRD通过抑制IL-6的表达,减少NF-κB的激活 [7]。在胶质母细胞瘤中,PTPRD的失活导致NF-κB活性增强,促进炎症因子的释放,营造促肿瘤微环境,并增强肿瘤细胞的放化疗抗性 [6];在肝癌中,PTPRD通过抑制NF-κB信号通路,减少炎症相关基因的表达,抑制肿瘤的发生发展 [1]。
2.4 CXCL8 / 血管生成信号通路:PTPRD抑制肿瘤转移的机制
CXCL8 / 血管生成信号通路是调控肿瘤血管生成的关键通路,PTPRD通过对该通路的调控影响肿瘤的生长和转移 [2]。正常情况下,PTPRD可通过抑制ERK和STAT3信号通路,减少CXCL8的转录和分泌 [2]。在胃癌中,PTPRD因基因突变、缺失或甲基化而失活,其对ERK和STAT3的抑制作用减弱,导致ERK和STAT3持续激活,进而上调CXCL8的表达。CXCL8与血管内皮细胞表面的受体结合后,激活血管内皮细胞的管形成能力,促进肿瘤血管生成,为肿瘤生长提供营养和氧气,同时还可促进胃癌细胞的迁移和侵袭,加速肿瘤转移 [2]。此外,在肝癌中,PTPRD的缺失也可导致CXCL8的表达升高,进一步促进肝癌的血管生成和进展 [1]。
2.5 Wnt/β-catenin通路:PTPRD在细胞粘附与迁移中的作用
Wnt/β-连环蛋白/TCF信号通路在胚胎发育和肿瘤发生中发挥重要作用,PTPRD对Wnt/β-连环蛋白/TCF信号通路的调控主要通过与β- 连环蛋白相互作用实现。PTPRD可通过其D2结构域与β-连环蛋白、E-钙粘蛋白等细胞粘附分子相互作用,同时对β-连环蛋白进行去磷酸化,抑制β-连环蛋白/TCF信号通路的激活,进而抑制细胞迁移和肿瘤进展 [1]。在结肠癌中,PTPRD与CD44协同作用,通过去磷酸化β-连环蛋白,抑制β-连环蛋白/TCF信号通路,从而抑制结肠癌细胞的迁移 [1];在肝癌中,PTPRD的失活导致β-连环蛋白/TCF信号通路异常激活,下游靶基因表达上调,促进肝癌细胞的增殖和侵袭 [1]。此外,PTPRD还可通过维持细胞间的粘附连接,进一步抑制β-连环蛋白的核转位,减弱其转录活性 [3]。
3. PTPRD与疾病治疗:从癌症到代谢及神经疾病
PTPRD的异常表达或功能缺失与多种疾病的发生发展密切相关,涉及癌症、代谢性疾病、神经系统疾病及其他疾病,其在不同疾病中的作用机制虽存在差异,但均通过调控关键信号通路影响疾病进程。
3.1 PTPRD在多种癌症中的抑癌角色与机制
3.1.1 肝癌(HCC):PTPRD的抑癌机制与预后价值
肝癌是全球癌症相关死亡的第三大原因,治疗方法疗效有限,探索新的分子靶点对肝癌的诊断和治疗至关重要 [1]。研究发现,PTPRD在肝癌组织中显著下调,其下调主要通过启动子高甲基化实现,且PTPRD的表达水平与肝癌的病理特征密切相关,高分级肝癌组织中PTPRD的表达水平低于低分级组织 [1]。PTPRD作为抑癌基因,通过多种机制抑制肝癌的发生发展:一方面,PTPRD可通过去磷酸化STAT3,抑制STAT3介导的促肿瘤信号通路,减少MMP-2、MMP-9等促增殖、促血管生成基因的表达;另一方面,PTPRD可通过调控PI3K/Akt/mTOR信号通路,抑制肝癌细胞的迁移和侵袭;此外,PTPRD还可通过负调控Wnt/β-连环蛋白/TCF信号通路,维持细胞间的粘附连接,抑制肝癌细胞的恶性转化 [1]。临床研究表明,PTPRD高表达的肝癌患者术后肿瘤复发率较低,生存率较高,提示PTPRD可作为肝癌预后评估的潜在生物标志物 [1]。
3.1.2 胃癌(GC):PTPRD缺失如何驱动肿瘤进展
胃癌是全球第五大常见癌症,第三大癌症相关死亡原因,尽管诊断和治疗技术有所进步,但晚期胃癌患者的预后仍较差 [2]。在胃癌中,PTPRD的表达频繁下调,约69%的胃癌组织中PTPRD表达降低(其中24%为低表达,45%为中等表达),且其表达缺失与胃癌的晚期分期、较差的总生存率及更高的远处转移风险相关 [2]。PTPRD在胃癌中的抑癌机制主要包括:通过抑制ERK和STAT3信号通路,下调CXCL8的表达,进而抑制肿瘤血管生成;与CD44、β-连环蛋白等细胞粘附分子相互作用,维持细胞间的粘附连接,抑制胃癌细胞的迁移和侵袭;此外,PTPRD还可通过调控细胞凋亡相关通路,促进胃癌细胞的凋亡 [2]。
3.1.3 胶质母细胞瘤(GBM):PTPRD缺失与治疗敏感性
胶质母细胞瘤是最常见且恶性程度最高的原发性脑肿瘤,患者中位生存期仅12-15个月 [6]。约50%的胶质母细胞瘤中存在PTPRD的失活,主要通过基因缺失、表观遗传沉默或失活突变实现 [6]。PTPRD在胶质母细胞瘤中的抑癌作用主要通过以下机制:直接与STAT3相互作用,去磷酸化STAT3并抑制其活性,减少STAT3下游靶基因的表达,抑制肿瘤细胞的增殖和肿瘤干细胞的维持;负调控NF-κB信号通路,减少炎症因子的释放,抑制促肿瘤微环境的形成,同时增强肿瘤细胞对放化疗的敏感性;此外,PTPRD还可通过调控细胞粘附分子的表达,抑制胶质母细胞瘤细胞的侵袭 [6]。研究表明,PTPRD缺失的胶质母细胞瘤患者对STAT3抑制剂更为敏感,提示PTPRD可作为胶质母细胞瘤治疗方案选择的生物标志物 [6]。
3.1.4 乳腺癌
乳腺癌是女性最常见的恶性肿瘤之一,PTPRD在乳腺癌中也发挥抑癌作用 [1,3]。研究发现,PTPRD在乳腺癌组织中表达下调,其缺失与乳腺癌的进展和转移密切相关 [1]。PTPRD通过去磷酸化STAT3,抑制IL-6/STAT3信号通路,进而抑制乳腺癌细胞的增殖和转移;同时,PTPRD还可通过下调ETK(上皮细胞酪氨酸激酶)的表达,进一步增强对乳腺癌进展的抑制作用 [1]。在乳腺癌动物模型中,外源性表达PTPRD可显著抑制肿瘤的生长和转移,提示PTPRD可作为乳腺癌治疗的潜在靶点 [1]。
3.1.5 其他癌症
除上述癌症外,PTPRD在结肠癌、黑色素瘤、头颈部鳞状细胞癌等多种癌症中也发挥抑癌作用 [1,3]。在结肠癌中,PTPRD与CD44协同作用,通过去磷酸化β-连环蛋白,抑制β-连环蛋白/TCF 信号通路,从而抑制结肠癌细胞的迁移 [1];在黑色素瘤中,PTPRD的表达缺失可促进黑色素瘤细胞的迁移,外源性表达PTPRD可显著降低黑色素瘤细胞的生长和存活能力,并增加细胞凋亡 [1];在头颈部鳞状细胞癌中,PTPRD的表观遗传改变可导致STAT3过度激活,PTPRD缺失的患者对STAT3抑制剂更为敏感,提示PTPRD可作为头颈部鳞状细胞癌预后评估和治疗选择的生物标志物 [3]。
3.2 PTPRD在代谢性疾病中的作用
3.2.1 2型糖尿病:PTPRD基因沉默与胰岛素抵抗
2型糖尿病是一种以胰岛素抵抗和胰岛素分泌不足为特征的代谢性疾病,PTPRD的异常与2型糖尿病的发生密切相关 [3,5]。基因组关联研究(GWAS)发现,PTPRD基因多态性与汉族人群2型糖尿病的易感性相关 [5]。机制上,PTPRD通过激活胰岛素受体信号通路维持正常的葡萄糖代谢,其可增强胰岛素受体的磷酸化水平,促进胰岛素信号的传递,同时还可激活PPARγ2,增强细胞对胰岛素的敏感性 [5]。在2型糖尿病患者中,PTPRD因DNA高甲基化而被沉默,导致其表达水平显著降低,胰岛素受体信号通路受损,细胞对胰岛素的敏感性下降,出现胰岛素抵抗 [5]。临床研究表明,2型糖尿病患者外周血中PTPRD的mRNA表达水平显著低于健康人群,且其表达水平与疾病持续时间呈负相关,疾病持续时间越长,PTPRD表达水平越低 [5]。
3.2.2 非酒精性脂肪肝(NAFLD):PTPRD的调控角色
非酒精性脂肪肝疾病是一种与胰岛素抵抗和肥胖相关的代谢性肝病,PTPRD在非酒精性脂肪肝疾病中也发挥作用 [1,3]。研究发现,PTPRD的单核苷酸多态性(SNP)与非酒精性脂肪肝疾病的发生相关,PTPRD可通过减弱STAT3(Tyr 705)的磷酸化,参与非酒精性脂肪肝疾病的病理过程 [1]。在非酒精性脂肪肝疾病患者中,PTPRD的表达水平降低,导致STAT3持续激活,促进炎症因子的释放和肝细胞的脂肪变性,进而加重疾病进展 [1]。此外,PTPRD还可通过调控脂质代谢相关基因的表达,影响肝细胞内脂质的积累,进一步参与非酒精性脂肪肝疾病的发生发展 [3]。
3.3 PTPRD功能障碍与神经系统疾病
3.3.1 认知障碍
认知障碍是一类以认知功能下降为特征的神经系统疾病,PTPRD的异常与认知障碍的发生密切相关 [1]。PTPRD在大脑中高表达,参与神经元的迁移、突触形成及神经信号传递 [1]。研究发现,PTPRD基因敲除小鼠会出现认知障碍,表现为学习和记忆能力下降 [1]。机制上,PTPRD可通过与SLITRK蛋白等神经细胞粘附分子相互作用,促进囊泡型GABA转运体的积累,维持突触的特化和稳定,其缺失会导致突触结构和功能异常,影响神经信号的正常传递,进而导致认知功能受损 [1]。此外,PTPRD还可通过调控神经递质的平衡,影响神经元的兴奋性,其功能异常可能进一步加重认知障碍 [1]。
3.3.2 听力丧失
听力丧失是一种常见的感觉障碍,PTPRD的异常也可能导致听力丧失 [1]。研究发现,PTPRD基因纯合微缺失的患者会出现三角头畸形、听力丧失和智力障碍等症状 [1]。机制上,PTPRD在听觉系统的发育和功能维持中发挥作用,其可能通过调控听觉神经细胞的存活和突触形成,维持正常的听觉功能,PTPRD的缺失会导致听觉神经细胞的凋亡和突触连接的破坏,进而引发听力丧失 [1]。此外,PTPRD还可通过调控内耳毛细胞的发育和功能,影响声音信号的传导,其功能异常可能进一步加重听力损伤 [1]。
3.4 其他疾病:从胎儿发育到高血压的潜在关联
3.4.1 宫内生长受限(IUGR)
宫内生长受限是指胎儿在子宫内生长发育迟缓,出生体重低于同孕周正常胎儿体重的第10百分位,PTPRD在宫内生长受限胎儿的肝脏代谢调控中发挥作用 [8]。研究发现,宫内生长受限胎儿肝脏中PTPRD的表达水平显著降低,且其表达降低与胎儿肝脏代谢紊乱密切相关 [8]。在宫内生长受限胎儿肝脏中,PTPRD的缺失可导致葡萄糖代谢、氨基酸降解等通路的异常,例如其可通过调控STAT3信号通路,影响糖异生相关基因的表达,导致胎儿肝脏葡萄糖生成增加,同时还可影响氨基酸的降解过程,导致肝细胞内氨基酸浓度升高 [8]。此外,PTPRD的缺失还可导致胎儿肝脏线粒体功能受损,能量生成减少,进一步加重胎儿的生长受限 [8]。
3.4.2 高血压
高血压是一种常见的心血管疾病,PTPRD的异常可能与高血压的发生相关 [1]。研究发现,PTPRD基因敲除小鼠会出现高血压症状,提示PTPRD在血压调节中发挥作用 [1]。机制上,PTPRD可能通过调控血管内皮细胞的功能,影响血管的舒张和收缩,其缺失会导致血管内皮细胞功能异常,血管舒张能力下降,进而导致血压升高 [1]。此外,PTPRD还可通过调控肾素-血管紧张素-醛固酮系统(RAAS)的活性,影响水钠代谢,其功能异常可能进一步加重高血压 [1]。
4. 靶向PTPRD:药物研发与治疗新策略
PTPRD靶点药物的研究在多个领域取得了进展。在肿瘤治疗方面,PTPRD在胃癌中经常被下调,其表达丧失与疾病晚期、总体生存率降低和远处转移风险增加相关,研究发现二甲双胍能有效抑制PTPRD失活诱导的血管生成,降低PTPRD失活癌细胞的活性,并逆转PTPRD表达的下降。在代谢性疾病领域,PTPRD通过抑制STAT3信号通路维持肝脏代谢平衡,其表达缺失与代谢性肝病的发生密切相关,为开发靶向PTPRD-STAT3轴的创新疗法提供了重要理论依据。在药物依赖治疗方面,NHB1109作为PTPRD的抑制剂,具有良好的口服生物利用度和耐受性,正在作为抗成瘾药物进行进一步开发。
5. 华美生物PTPRD研究相关产品推荐
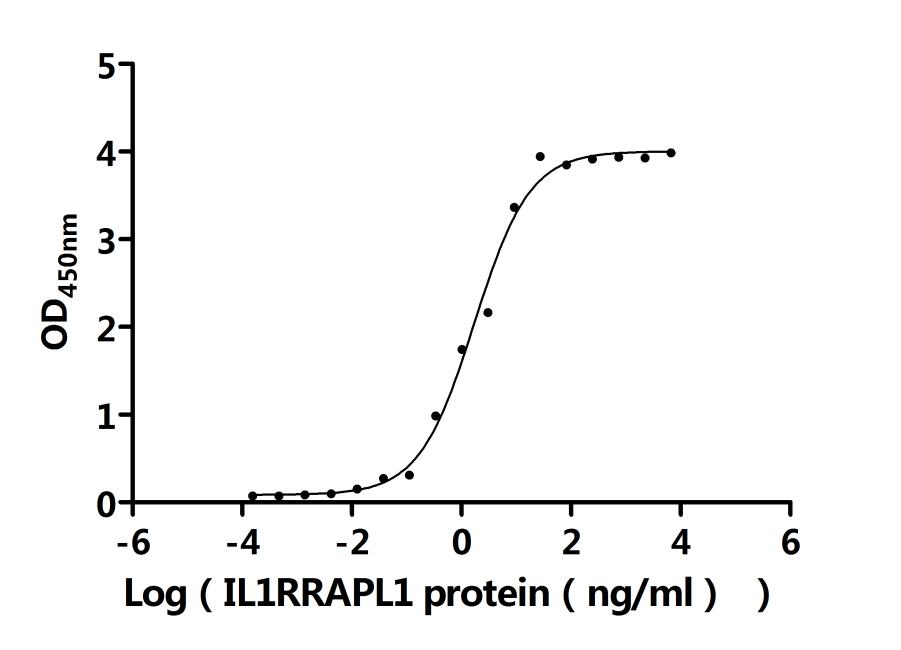
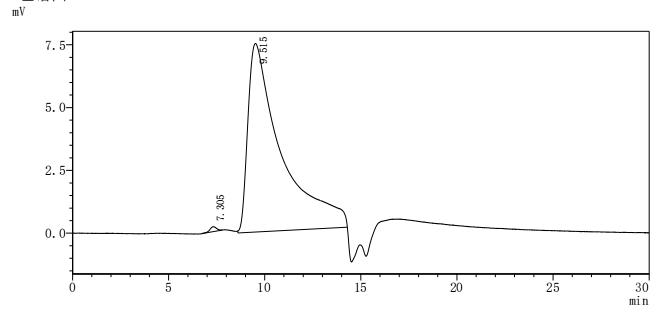
● PTPRD 重组蛋白
Recombinant Human Receptor-type tyrosine-protein phosphatase delta (PTPRD), partial (Active); CSB-MP019051HU(A4)

参考文献:
[1] Huang X, Qin F, Meng Q, et al. Protein tyrosine phosphatase receptor type D (PTPRD)-mediated signaling pathways for the potential treatment of hepatocellular carcinoma: a narrative review[J]. Ann Transl Med, 2020, 8(18): 1192.
[2] Bae WJ, Ahn JM, Byeon HE, et al. PTPRD-inactivation-induced CXCL8 promotes angiogenesis and metastasis in gastric cancer and is inhibited by metformin[J]. J Exp Clin Cancer Res, 2019, 38(1): 484.
[3] Kim M, Morales LD, Jang IS, et al. Protein Tyrosine Phosphatases as Potential Regulators of STAT3 Signaling[J]. Int J Mol Sci, 2018, 19(9): 2708.
[4] Jones AK, Brown LD, Rozance PJ, et al Differential effects of intrauterine growth restriction and a hyperinsulinemic-isoglycemic clamp on metabolic pathways and insulin action in the fetal liver[J]. Am J Physiol Regul Integr Comp Physiol, 2019, 316(5): R427-R440.
[5] Chen YT, Lin WD, Liao WL, et al. PTPRD silencing by DNA hypermethylation decreases insulin receptor signaling and leads to type 2 diabetes[J]. Oncotarget, 2015, 6(15): 12997-13005.
[6] Gray GK, McFarland BC, Nozell SE, et al. NF-κB and STAT3 in Glioblastoma: Therapeutic Targets Coming of Age[J]. Expert Rev Neurother, 2014, 14(11): 1293-1306.
[7] Jiang Y, Han Q, Zhao H, et al. The Mechanisms of HBV-Induced Hepatocellular Carcinoma[J]. J Hepatocellular Carcinoma, 2021, 8: 435-450.
[8] Wesolowski SR, Hay WW Jr. Role of placental insufficiency and intrauterine growth restriction on the activation of fetal hepatic glucose production[J]. Mol Cell Endocrinol, 2016, 435: 61-68.



