武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
肿瘤干细胞的“命门”:LGR5成80亿美元收购焦点
279 人阅读发布时间:2025-10-24 10:50
9月29日,Genmab宣布,公司与Merus达成收购协议,将以每股97美元的价格收购后者的全部股份,总金额约为80亿美元。LGR5/EGFR双抗Petosemtamab是Genmab此次发起收购的主要目标,目前正处于3期临床开发阶段,通过同时靶向EGFR和LGR5,能够更精准地识别和攻击肿瘤细胞,展现出显著的抗肿瘤活性。
此次收购让LGR5再次进入大众视野,从肠道再生到结直肠癌治疗,LGR5正重塑我们对“干细胞命运”的理解。本文将带你系统了解这一分子如何连接干细胞与癌症,揭示其背后的信号通路与药物研发新进展。
LGR5(Leucine-rich repeat-containing G protein-coupled receptor 5)属于富含亮氨酸重复序列的G蛋白偶联受体(GPCR)家族成员,其典型结构包括七次跨膜结构域和胞外N端富含亮氨酸重复序列(LRR)的结合区 [1]。该结构决定了LGR5兼具配体识别与信号转导的双重功能。LRR结构域通常由18–25个重复单元组成,通过β-折叠片层形成稳定结构,可与R-spondin(RSPO)家族配体特异性结合;跨膜区则通过构象变化激活下游G蛋白信号转导 [2]。
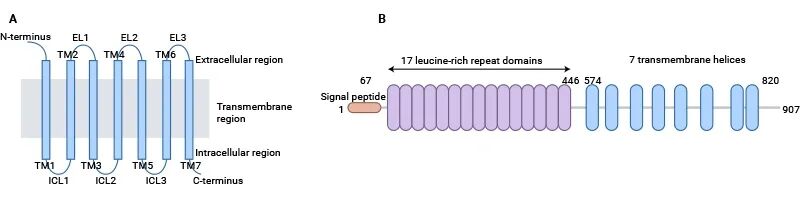
图1. Schematic presentation of the general structure of GPCRs and LGR5 [1]
研究显示,LGR5胞内第三环结构含有多个磷酸化位点,能够招募β-arrestin介导信号内化,在Wnt/β-catenin等通路中发挥动态调控作用 [3]。在信号传导中,LGR5通过双重机制增强Wnt信号强度:一方面,LGR5-RSPO复合物与Wnt共受体LRP5/6结合,抑制E3泛素连接酶RNF43/ZNRF3对Wnt受体的内吞降解,从而延长信号激活时间;另一方面,LGR5的Gαs亚基偶联可激活cAMP-PKA通路,通过β-catenin的Ser675位点磷酸化增强其转录活性 [4]。
单细胞测序结果显示,LGR5阳性干细胞中Wnt靶基因AXIN2与LEF1表达显著高于普通细胞,提示其具有信号放大功能 [1]。此外,LGR5胞内C端的PDZ结合基序能与DLG1等支架蛋白形成复合体,进一步调控细胞极性和迁移 [3]。
在组织层面,LGR5呈现明显的特异性表达模式。在肠道隐窝基底柱状细胞中,LGR5通过维持Wnt信号梯度调控干细胞的自我更新与分化 [2];在毛囊隆突区,LGR5与BMP信号协同控制毛囊再生周期 [4]。此外,部分LGR5的剪切变体(如可溶性形式)可竞争性结合配体产生负调控效应,这种异构体在结直肠癌中异常高表达,与肿瘤干性维持密切相关。冷冻电镜结构解析揭示,LGR5与RSPO2结合界面中Arg72与Glu110等关键残基为设计靶向抑制剂提供了结构基础 [3]。
LGR5的结构特征决定了其在组织发育与稳态维持中的重要功能。其胞外域含有17个亮氨酸重复序列,可与RSPO家族配体结合并激活下游信号通路。研究发现,LGR5在肠道隐窝基底干细胞中高表达,通过维持Wnt/β-catenin通路活性促进干细胞自我更新和平衡分化,对肠上皮持续再生具有关键作用 [5]。在肝组织中,LGR5阳性细胞在损伤后可快速增殖,促进胆管上皮修复与再生。在皮肤系统中,LGR5在毛囊隆突区干细胞中周期性表达,维持毛囊再生循环。
在胚胎发育过程中,LGR5参与间充质干细胞定向分化,敲除模型显示其缺失导致长骨生长板结构异常。在成体组织修复中,LGR5阳性细胞表现出迁移和多向分化潜能。例如,在心肌梗死模型中,心外膜LGR5+细胞可转分化为心肌细胞与血管内皮细胞,促进组织重建。此外,LGR5表达水平与干细胞干性密切相关,其下调会导致干细胞池耗竭并加速组织老化。
在肠道菌群与宿主互作中,LGR5通过调控胆汁酸代谢维持肠屏障功能,表达异常与黏膜通透性增加及炎症反应增强相关。阻塞性睡眠呼吸暂停患者脂肪组织研究亦表明,LGR5表达变化与脂代谢紊乱存在协同调控关系,提示其在代谢稳态中具有重要作用 [2]。
Wnt/β-catenin信号通路激活机制
LGR5通过结合R-spondin蛋白家族成员,形成LGR5–RSPO–Wnt受体复合物,从而增强Wnt配体与Frizzled受体结合的稳定性,抑制RNF43/ZNRF3介导的Wnt受体降解,延长Wnt/β-catenin信号的活化 [6]。这种调控是细胞命运决定与干性维持的关键机制。结构研究表明,LGR5的17个亮氨酸重复单元构成马蹄形结合域,为RSPO提供高亲和力结合位点 [5]。
LGR5介导的Wnt信号调控具有剂量依赖特征。R-spondin的存在可使LGR5介导的信号强度提高十倍以上,而LGR5缺失则导致肠道类器官形成完全受阻 [7]。其胞内第三环(ICL3)可调控Wnt受体Frizzled的膜稳定性,并参与E3泛素连接酶的募集 [8]。
核内β-catenin与TCF/LEF复合物结合后,可上调MYC、CCND1和AXIN2等靶基因转录,调节细胞增殖与分化。此外,β-catenin/TCF复合物还能结合LGR5启动子上的TCF结合元件,形成正反馈环路,持续放大信号通路活性 [9]。
表观遗传调控同样参与LGR5相关信号激活。ChIP测序结果显示,LGR5高表达细胞中H3K27ac修饰富集,DNA甲基转移酶DNMT1活性下降,导致染色质开放及Wnt靶基因活化[8]。靶向Porcupine的抑制剂LGK974可阻断Wnt配体分泌,有效抑制LGR5阳性肿瘤干细胞自我更新,目前已进入临床试验 [9]。
与其他信号通路的交叉调控
除经典Wnt通路外,LGR5还与多条信号网络存在交互。在脂代谢方面,LGR5影响PPARγ的表达,调控脂肪细胞分化与能量代谢平衡 [2]。在氧化应激下,LGR5可通过调节FoxO1的核转位影响抗氧化酶表达,维持基因组稳定性。
此外,LGR5还与Notch通路、TGF-β信号及非经典Wnt/PCP途径存在交互调控。病毒感染状态下,LGR5表达变化可干扰Notch靶基因Hes1的转录活性,影响细胞分化进程。在结直肠癌中,LGR5高表达通过RSPO增强Wnt信号传导,并通过表观遗传机制沉默抑癌基因,形成正反馈环路 [7][8]。LGR5与TGF-β/Smad通路的互作则可促进上皮-间质转化,增强肿瘤侵袭性。这些交叉机制凸显了LGR5作为信号枢纽的多功能性。
LGR5信号异常与多种疾病密切相关。在结直肠癌中,LGR5通过Wnt/β-catenin通路过度激活促进肿瘤干性维持,其高表达与肿瘤复发、转移及耐药显著相关 [7]。LGR5阳性细胞通过稳定β-catenin核转位上调c-Myc、Cyclin D1等基因,驱动细胞周期异常和上皮-间质转化 [5]。表观遗传分析表明,LGR5启动子去甲基化是其高表达的重要原因 [8]。
在代谢性疾病中,LGR5与脂代谢通路交叉调控,阻塞性睡眠呼吸暂停(OSA)患者中LGR5与脂质代谢紊乱显著相关,可能通过FoxO信号影响氧化应激反应 [2]。在心血管系统中,LGR5异常表达会影响血管生成与内皮功能,提示其在多种慢性疾病中具有潜在靶向价值。
在结直肠癌中的作用
LGR5作为肿瘤干细胞标志物,在结直肠癌中通过激活Wnt信号促进肿瘤细胞增殖、迁移与化疗耐药 [7]。LGR5–RSPO复合物通过抑制RNF43/ZNRF3延长Wnt信号激活,诱导β-catenin核转位及下游c-Myc、Cyclin D1转录 [5]。
结直肠癌微环境中,LGR5与PI3K/AKT通路协同调控代谢重编程,增强脂肪酸摄取以满足能量需求 [2]。LGR5+细胞常富集于肿瘤前沿区,与EMT标志物N-cadherin、vimentin共表达,推动转移发生 [11]。动物实验表明,LGR5敲除可显著抑制肿瘤生长与转移,并增强5-FU敏感性 [7]。
靶向治疗策略包括阻断RSPO/LGR5相互作用的单克隆抗体、Wnt下游小分子抑制剂及表观遗传调控药物。抗LGR5抗体偶联药物(ADC)能特异性清除肿瘤干细胞,与PD-1抑制剂联合时可显著增强免疫反应 [5]。此外,HDAC抑制剂通过染色质重塑下调LGR5表达,逆转耐药表型 [10]。LGR5靶向CAR-T疗法已进入Ⅰ期临床,其主要挑战在于避免对正常肠道干细胞的毒性作用 [11]。
在其他疾病中的作用
在阻塞性睡眠呼吸暂停(OSA)中,LGR5通过调控脂代谢参与疾病进程。患者外周血单核细胞中LGR5表达升高,与甘油三酯及低密度脂蛋白水平呈正相关 [2]。单细胞RNA测序发现,OSA患者呼吸道组织中LGR5+细胞富集,表现出增强的炎症与氧化应激反应 [12]。
在肝脏疾病中,LGR5阳性肝前体细胞的异常增殖与肝纤维化及肝癌发生密切相关。斑马鱼肝肿瘤模型显示,LGR5激活Wnt信号促进肝星状细胞活化及胶原沉积 [13]。临床样本分析显示,LGR5在肝硬化组织中较正常肝升高3–5倍,且与疾病严重程度正相关 [13][14]。
此外,LGR5阳性干细胞耗竭与衰老密切相关。老年肠道类器官中LGR5表达下降伴随增殖能力减弱;在阿尔茨海默病模型中,LGR5下调导致神经再生受损和认知衰退 [12];皮肤研究表明,LGR5阳性毛囊干细胞减少与皮肤老化特征直接相关。
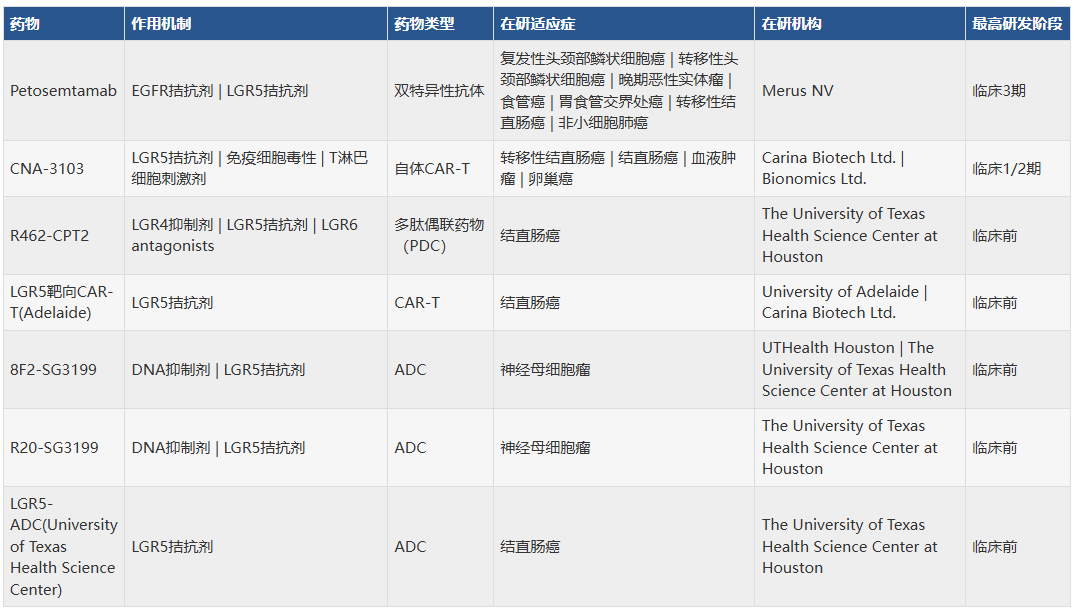
目前,针对LGR5的药物开发主要集中于抗体药(双抗、ADC)及细胞治疗(CAR-T)药物上。适应症以结直肠癌为主。最高研发阶段为临床3期,Petosemtamab,也是此次收购的重要标的。其余在研管线总结如下表:
● LGR5重组蛋白
Recombinant Human Leucine-rich repeat-containing G-protein coupled receptor 5 (LGR5)-VLPs (Active) ; CSB-MP012906HU(A4)
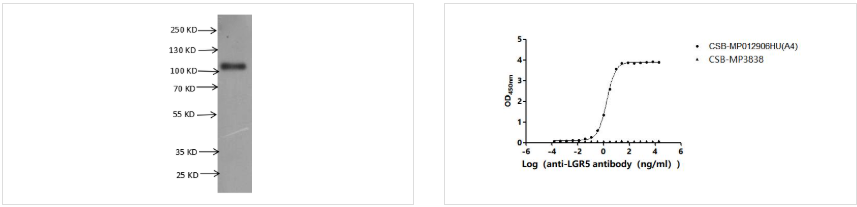
● LGR5抗体
LGR5 Recombinant Monoclonal Antibody; CSB-RA262034A0HU

LGR5 Antibody; CSB-PA012906LA01HU

[1] Kaavya Krishna Kumar1,Antony W Burgess,Jacqueline M Gulbis. Structure and function of LGR5: an enigmatic G-protein coupled receptor marking stem cells[J]. Protein Sci, 2014, 5.
[2] Peng Lü, Xiaodi Wang, Dan Bing. Identification and Validation of Prognostic Factors of Lipid Metabolism in Obstructive Sleep Apnea[J]. Frontiers in Genetics, 2021, 12.
[3]Sang-Myung Jung, Seonghun Kim. In vitro Models of the Small Intestine for Studying Intestinal Diseases[J]. Frontiers in Microbiology, 2022, 12.
[4] Hong Ouyang, Jeffrey L. Goldberg, Shuyi Chen, Wei Li, Guo-Tong Xu, Wei Li, Kang Zhang, Robert B. Nussenblatt, Wei Li, Ting Xie, Chi‐Chao Chan, Donald J. Zack. Ocular Stem Cell Research from Basic Science to Clinical Application: A Report from Zhongshan Ophthalmic Center Ocular Stem Cell Symposium[J]. International Journal of Molecular Sciences, 2016, 17(3): 415-415.
[5] Jia Bian, Marius Dannappel, Chunhua Wan, Ron Firestein. Transcriptional Regulation of Wnt/β-Catenin Pathway in Colorectal Cancer[J]. Cells, 2020, 9(9): 2125-2125.
[6] Clémence Bonnet, Anvi Brahmbhatt, Sophie X. Deng, Jie Zheng. Wnt signaling activation: targets and therapeutic opportunities for stem cell therapy and regenerative medicine[J]. RSC Chemical Biology, 2021, 2(4): 1144-1157.
[7] Hui Zhao, Tianqi Ming, Shun Tang, Shan Ren, Han Yang, Maolun Liu, Tao Qiu, Haibo Xu. Wnt signaling in colorectal cancer: pathogenic role and therapeutic target[J]. Molecular Cancer, 2022, 21(1).
[8] Ankita Sharma, Rafeeq Mir, Sanjeev Galande. Epigenetic Regulation of the Wnt/β-Catenin Signaling Pathway in Cancer[J]. Frontiers in Genetics, 2021, 12.
[9] Dario Zimmerli, George Hausmann, Claudio Cantù, Konrad Basler. Pharmacological interventions in the Wnt pathway: inhibition of Wnt secretion versus disrupting the protein–protein interfaces of nuclear factors[J]. British Journal of Pharmacology, 2017, 174(24): 4600-4610.
[10] Bing Liang, Yanhong Wang, Jiazhen Xu, Yingchun Shao, Dongming Xing. Unlocking the potential of targeting histone-modifying enzymes for treating IBD and CRC[J]. Clinical Epigenetics, 2023, 15(1).
[11] Yagmur Azbazdar, Mustafa Karabicici, Esra Erdal, Günes Özhan. Regulation of Wnt Signaling Pathways at the Plasma Membrane and Their Misregulation in Cancer[J]. Frontiers in Cell and Developmental Biology, 2021, 9.
[12] Hina Agraval, Hong Wei Chu. Lung Organoids in Smoking Research: Current Advances and Future Promises[J]. Biomolecules, 2022, 12(10): 1463-1463.
[13] Qizhuan Lin, Libo Jin, Renyi Peng. New Progress in Zebrafish Liver Tumor Models: Techniques and Applications in Hepatocellular Carcinoma Research[J]. International Journal of Molecular Sciences, 2025, 26(2): 780-780.
[14] Yaqi Li, Peiyuan Tang, Sanjun Cai, Junjie Peng, Guoqiang Hua. Organoid based personalized medicine: from bench to bedside[J]. Cell Regeneration, 2020, 9(1)



