武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
SEZ6:神经内分泌肿瘤治疗新靶点,多款ADC临床在研
439 人阅读发布时间:2025-07-25 10:42
1. SEZ6背景介绍
Seizure-related 6 homolog(癫痫相关同源物6,SEZ6)是一种跨膜蛋白,最初因与癫痫相关而被发现 [1]。其基因定位于染色体 17q21.33,编码的蛋白包含多个结构域,在神经系统中具有重要作用。
SEZ6的表达具有组织特异性。在正常组织中,SEZ6主要在脑(如小脑、大脑、脊髓)和垂体中表达,而在其他组织(如肺、肝、肾等)中表达量极低 [2,3]。RNA测序和免疫组织化学(IHC)分析显示,SEZ6在小细胞肺癌(SCLC)、神经内分泌癌(NECs)等神经内分泌肿瘤中高表达,且与神经内分泌标志物chromogranin A(CHGA)的表达高度相关 [2]。在73例原发性SCLC样本中,约78%的肿瘤存在SEZ6阳性表达,平均阳性率为40.4%,表明其在SCLC中具有较高的 prevalence [2]。
此外,SEZ6在小鼠内耳的神经感觉毛细胞中也有表达,且在胚胎、出生后及成年阶段均持续存在,提示其在听觉系统发育和功能维持中可能发挥作用 [3]。
2. SEZ6研究机制
SEZ6是β- 分泌酶(BACE1)的重要底物。BACE1可切割SEZ6的胞外域,产生可溶性ectodomain(sSEZ6)和跨膜C端片段(SEZ6-CTF);随后,SEZ6-CTF可被γ-分泌酶进一步切割,释放胞内域(SEZ6-ICD)[4]。这一切割过程在神经元中高度特异性发生,且对SEZ6的功能至关重要。
在SCLC中,SEZ6作为细胞表面蛋白,可被特异性抗体(如 SC17)识别并诱导快速内化,这一特性使其成为抗体-药物偶联物(ADC)的理想靶点 [2]。研究显示,靶向SEZ6的ADC(如 ABBV-011)可通过内化进入肿瘤细胞,释放细胞毒性payload(如 calicheamicin),从而特异性杀伤SEZ6阳性肿瘤细胞 [2]。
3. SEZ6相关信号通路
3.1 BACE1-SEZ6-γ-secretase通路
该通路是SEZ6最核心的信号通路。BACE1切割SEZ6产生的SEZ6-CTF可通过结合ERM蛋白传递信号,调控细胞骨架重组(如生长锥塌陷);而γ-分泌酶对SEZ6-CTF的进一步切割则可终止该信号,使细胞恢复对新信号的响应能力 [4]。在神经元中,这一通路参与轴突导向和突触可塑性调节 [4]。
3.2 与神经内分泌信号的关联
在SCLC中,SEZ6的表达与CHGA等神经内分泌标志物高度相关 [2],提示其可能参与ASCL1(一种驱动神经内分泌细胞命运的转录因子)调控的信号通路。研究显示,SEZ6是ASCL1的下游靶基因,在ASCL1高表达的SCLC亚型中显著上调 [2]。
3.3 听觉信号通路
在小鼠内耳中,SEZ6在毛细胞的stereocilia和胞质中表达,可能通过调控离子通道(如钾通道)参与听觉信号的传递与整合 [3]。其突变可能影响毛细胞的结构和功能,导致听力障碍。
4. SEZ6相关疾病
4.1 肿瘤
4.1.1 小细胞肺癌(SCLC)
SEZ6在SCLC中高表达,且与不良预后相关——高SEZ6表达的SCLC患者生存期更短 [2]。机制上,SEZ6可能通过与ezrin-radixin-moesin(ERM)家族蛋白相互作用,影响肿瘤细胞的骨架动态,从而促进肿瘤生长和侵袭 [2,3]。基于其高特异性和内化特性,靶向SEZ6的ADC(如 ABBV-011、ABBV-706)已进入临床试验,用于治疗复发/难治性 SCLC [2,6]。
4.1.2 神经内分泌癌(NECs)
SEZ6在NECs中同样高表达,是潜在的治疗靶点,相关联合治疗(如与 PD-1 抑制剂、铂类药物联用)正在研究中 [6]。
4.2 听力障碍
SEZ6 的纯合错义突变(如 c.2092G>A:p.Val698Ile)与常染色体隐性非综合征性听力障碍相关。在巴基斯坦近亲家系中,该突变导致SEZ6蛋白结构异常,影响内耳毛细胞功能,表现为先天性重度感音神经性耳聋 [3]。SEZ6在小鼠内耳的神经感觉毛细胞中表达,且在胚胎、出生后及成年阶段均持续存在,提示其在听觉系统发育和功能维持中发挥作用 [3]。
4.3 神经系统疾病
4.3.1 癫痫
SEZ6最初因与癫痫相关而被命名,其表达异常可能通过影响神经元兴奋性参与癫痫发作 [1,7]。
4.3.2 阿尔茨海默病(AD)
SEZ6是BACE1的底物,而BACE1是AD中Aβ产生的关键酶。BACE1抑制剂可减少SEZ6的切割,导致突触可塑性受损(如 LTP 降低),提示SEZ6可能参与AD的突触功能障碍 [4,8]。SEZ6敲除小鼠的皮质锥体细胞树突分支减少,兴奋性异常,海马区树突棘密度降低,导致空间记忆缺陷 [4]。
4.3.3 认知与行为异常
SEZ6敲除小鼠表现出认知缺陷、运动协调障碍和情绪反应异常,与人类的智力障碍和精神分裂症表型相关)[4]。SEZ6通过调控kainate受体亚基GluK2和GluK3的糖基化与运输,影响突触传递 [3],这可能是其导致认知异常的机制之一。
5. SEZ6靶点药物研究进展
SEZ6在正常组织中低表达、但在神经内分泌肿瘤(如小细胞肺癌SCLC)中高表达,因此成为抗体偶联药物(ADC)的热门靶点。目前已有多条ADC管线在研,适应症以小细胞肺癌为主,最高研发阶段临床1期。部分在研管线列举如下:
| 药物 | 作用机制 | 药物类型 | 在研适应症(疾病名) | 在研机构 | 最高研发阶段 |
|---|---|---|---|---|---|
| SC-011 | DNA抑制剂 | SEZ6抑制剂 | ADC | 难治性小细胞肺癌 | AbbVie, Inc. | 临床1期 |
| ABBV-706 | SEZ6抑制剂 | T_O_P_1_抑制剂 | ADC | 晚期恶性实体瘤 | 小细胞肺癌 | 复发性小细胞肺癌 | 难治性小细胞肺癌 | 非小细胞肺癌 | AbbVie, Inc. | 临床1期 |
| DLL3xSEZ6 bsADC(Biocytogen) | DLL3抑制剂 | SEZ6抑制剂 | T_O_P_1_抑制剂 | ADC | 小细胞肺癌 | Biocytogen Boston Corp. | 临床前 |
| DEC-002 | SEZ6抑制剂 | ADC | 肿瘤 | 无锡药明生物技术股份有限公司 | Whitehawk Therapeutics, Inc. | 杭州多禧生物科技有限公司 | 临床前 |
| HWK-206 | SEZ6调节剂 | ADC | 神经内分泌癌 | 小细胞肺癌 | Whitehawk Therapeutics, Inc. | 临床前 |
(数据来源于Patsnap)
6. 华美生物SEZ6研究相关产品推荐
● PTH重组蛋白
Recombinant Human Seizure protein 6 homolog (SEZ6), partial (Active); CSB-MP684467HU2
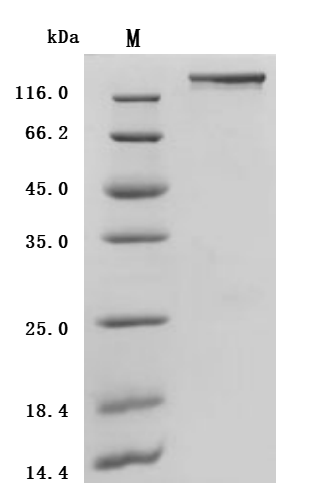
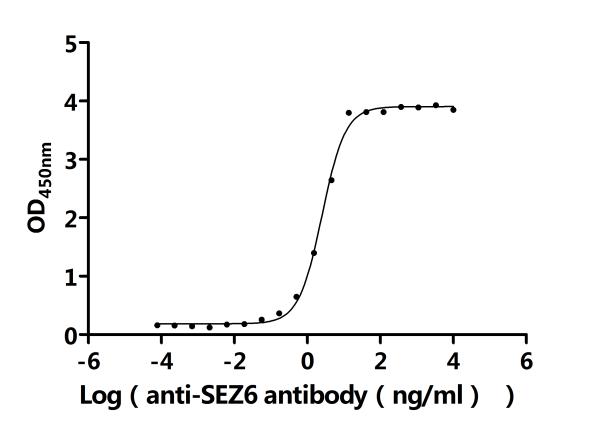
Recombinant Macaca fascicularis Seizure related 6 homolog (SEZ6), partial (Active); CSB-MP6419MOV
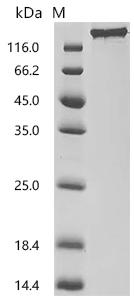
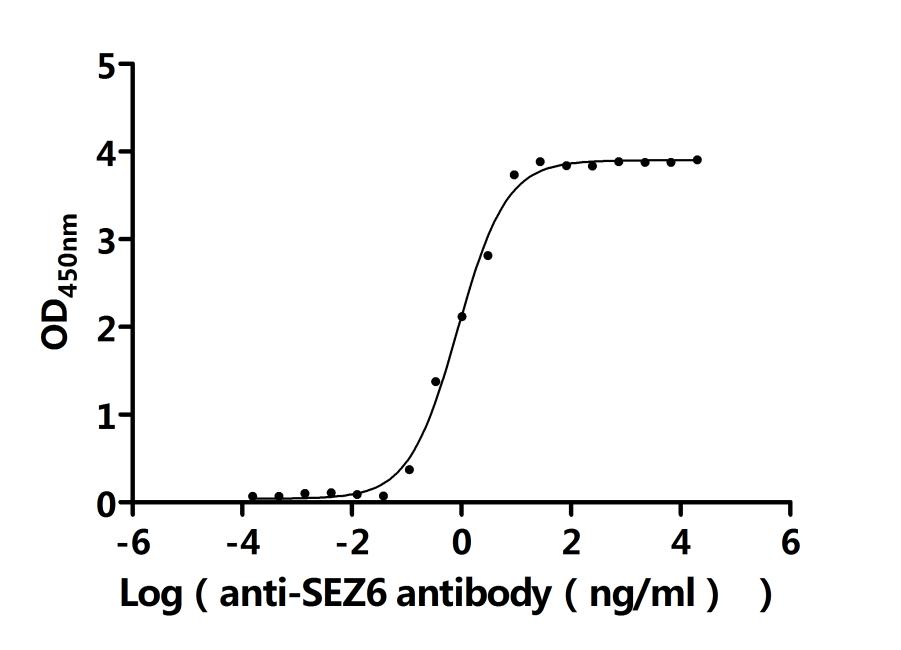
● SEZ6抗体
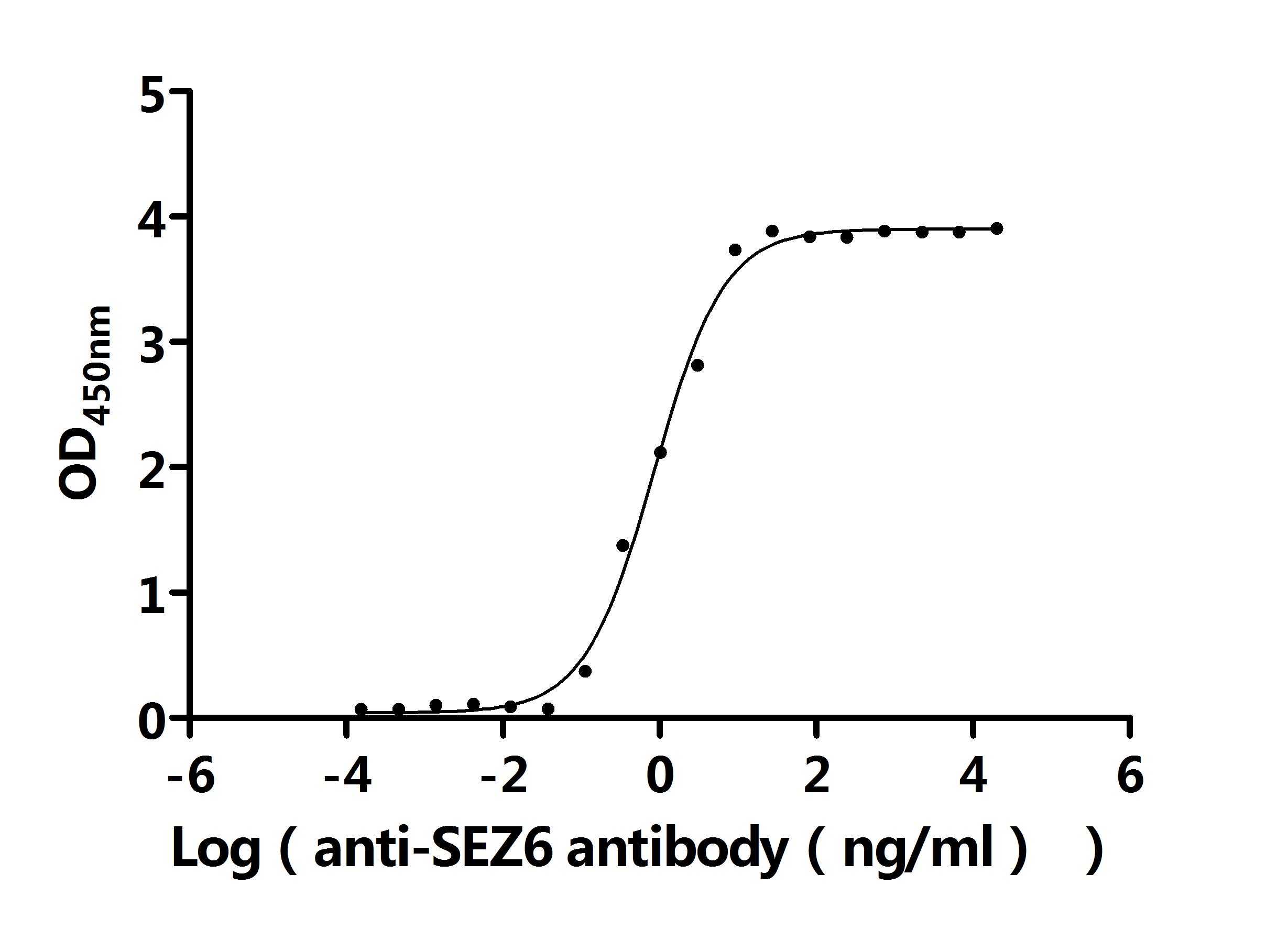
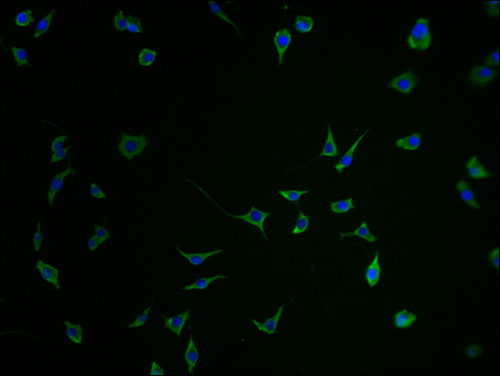
SEZ6 Recombinant Monoclonal Antibody; CSB-RA684467MA1HU
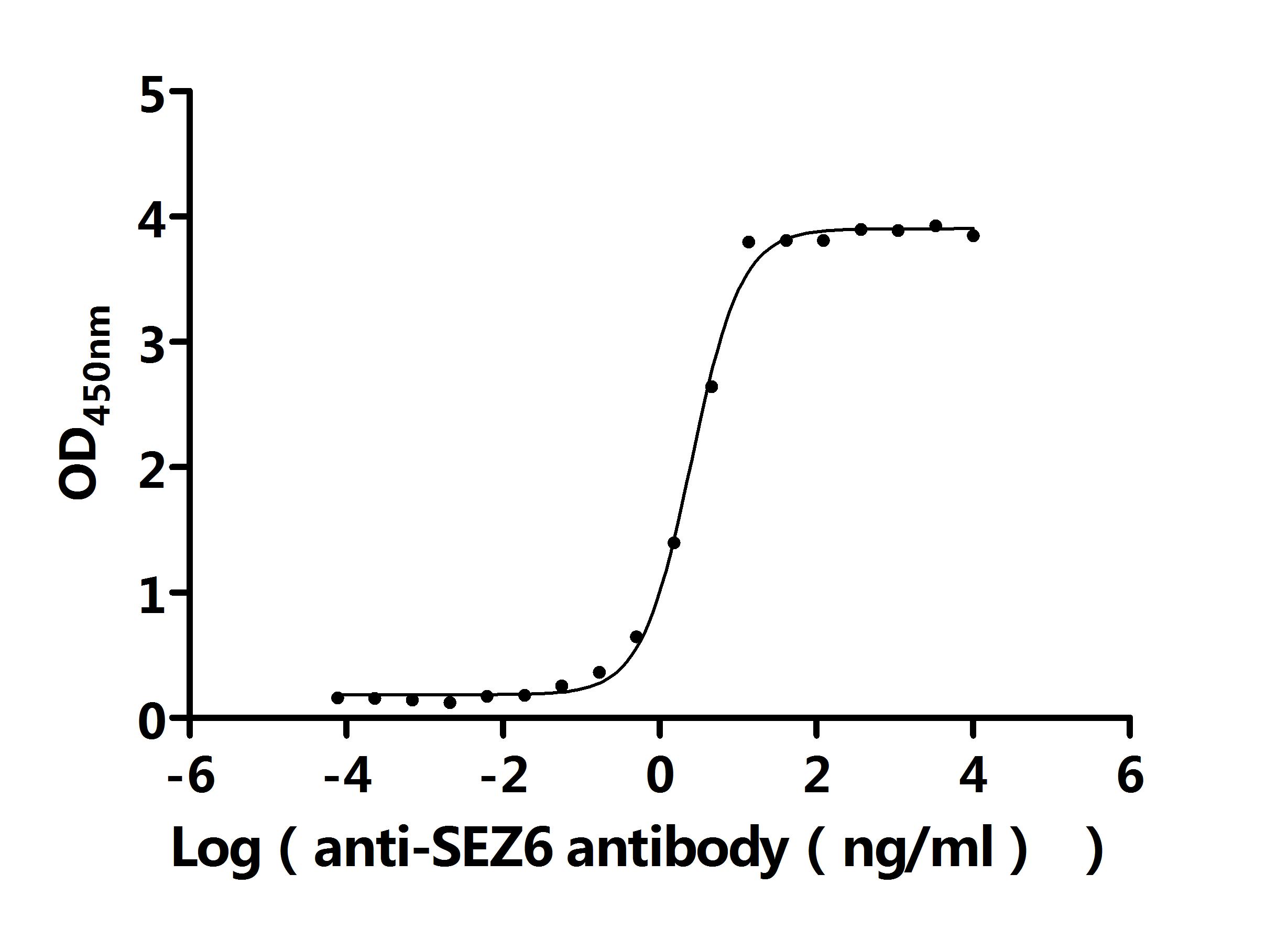
SEZ6 Antibody; CSB-PA684467HA01HU
参考文献:
[1] Gunnersen JM, Kim MH, Fuller SJ, et al. Sez-6 proteins affect dendritic arborization patterns and excitability of cortical pyramidal neurons. Neuron, 2007, 56: 621-639.
[2] Wiedemeyer WR, Gavrilyuk J, Schammel A, et al. ABBV-011, A Novel, Calicheamicin-Based Antibody–Drug Conjugate, Targets SEZ6 to Eradicate Small Cell Lung Cancer Tumors. Molecular Cancer Therapeutics, 2022, 21(6): 986-998.
[3] Bharadwaj T, Schrauwen I, Rehman S, et al. ADAMTS1, MPDZ, MVD, and SEZ6: candidate genes for autosomal recessive nonsyndromic hearing impairment. European Journal of Human Genetics, 2022, 30: 22-33.
[4] Shimizu-Nishikawa K, Kajiwara K, Kimura M, et al. Cloning and expression of SEZ-6, a brain-specific and seizure-related cDNA. Brain Res Mol Brain Res, 1995, 28: 201-210.
[5] Ohno M, Sametsky EA, Younkin LH, et al. BACE1 deficiency rescues memory deficits and cholinergic dysfunction in a mouse model of Alzheimer's disease. Neuron, 2004, 41: 27-33.
[6] Chandana S, Garmezy B, Dowlati A, et al. Phase I study of ABBV-706, an anti-SEZ6 antibody-drug conjugate, alone or in combination in adults with advanced solid tumors. Annals of Oncology, 2023, 34(S2): S1077.
[7] Pigoni M, Hsia HE, Hartmann J, et al. Seizure protein 6 controls glycosylation and trafficking of kainate receptor subunits GluK2 and GluK3. EMBO J, 2020, 39: e103457.
[8] Zhu K, Xiang X, Filser S, et al. BACE1 Inhibition Impairs Synaptic Plasticity via Seizure Protein 6. Biological Psychiatry, 2017, doi:10.1016/j.biopsych.2016.12.023.



