武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
甲状旁腺激素(PTH):调控钙磷代谢与骨骼健康的关键靶点
434 人阅读发布时间:2025-07-25 09:58
1. PTH的背景介绍
甲状旁腺激素(PTH)是由甲状旁腺分泌的关键激素,主要功能是维持钙磷代谢稳态,对骨代谢、肾脏钙重吸收及肠道钙吸收具有重要调节作用 [1]。其分泌受血钙水平通过钙敏感受体(CaSR)负反馈调节,同时受维生素D、磷等因素影响 [2]。PTH作用机制复杂,涉及多种信号通路,并与多种疾病密切相关,通过PTH1R受体介导,调控骨代谢、矿物质稳态及相关疾病的发生发展。
2. PTH的研究机制
2.1 骨代谢调节
PTH通过直接作用于成骨细胞和破骨细胞调节骨周转。间歇性PTH给药可激活成骨细胞的合成代谢通路,促进骨形成,其机制与增加成骨细胞数量、延缓凋亡及增强基质沉积相关 [3]。成骨细胞在PTH作用下通过有氧糖酵解和氧化磷酸化获取能量,满足胶原合成等耗能过程的需求 [3]。此外,PTH可刺激骨marrow脂肪细胞(BMAdipo)的脂解作用,释放脂肪酸为骨形成提供能量 [3]。
2.2 钙磷稳态调控
在肾脏,PTH促进钙重吸收并抑制磷重吸收,同时刺激1,25-二羟维生素D的合成,间接增强肠道钙吸收 [3]。在甲状旁腺中,CaSR通过感知血钙水平调控PTH分泌,而γ-氨基_丁_酸_B1受体(GABAB1R)与CaSR形成异源二聚体,可负性调节CaSR信号,促进PTH过度分泌,这一机制在甲状旁腺功能亢进中起重要作用 [2]。
2.3 与其他物质的相互作用
尿毒症毒素吲哚硫酸盐(IS)可与PTH相互作用影响骨细胞功能:在成熟骨细胞中,IS上调骨吸收相关基因(如RANKL/OPG)和氧化应激基因(NOX1、NOX4),而PTH则下调骨形成抑制基因(SOST、Dkk1),二者通过不同机制影响骨重塑 [4];在骨细胞矿化阶段,IS与PTH协同抑制碱性磷酸酶活性,阻碍矿化过程 [4]。
3. PTH的信号通路
3.1 PTH1R介导的经典通路
PTH主要通过PTH1R(G蛋白偶联受体)传递信号,其下游通路包括:
- cAMP/PKA通路:为主要通路,PTH结合后激活腺苷酸环化酶,使cAMP升高并激活PKA,调控骨形成相关基因(如IGF-1、FGF2)表达 [3,5]。
- PLC/PKC通路:高浓度PTH可激活磷脂酶C(PLC),水解PIP2生成IP3和DAG,IP3促进细胞内钙释放,DAG激活PKC,参与骨细胞分化调节 [3]。
3.2 异源受体相互作用
CaSR与GABAB1R在甲状旁腺细胞中形成异源二聚体,GABA通过自分泌方式结合该复合物,抑制CaSR的钙敏感性,减弱对PTH分泌的负反馈,导致PTH过度分泌 [2]。
3.3 信号通路的干扰与阻断
- 免疫测定干扰:鼠源抗体(如Oregovomab)可能与检测试剂中的抗鼠抗体交叉反应,导致PTH测定值假性升高 [6]。
- 自身抗体阻断:PTH1R的自身抗体可结合其胞外域,阻断PTH结合及下游cAMP信号,引发PTH抵抗和低钙血症 [5]。
4. PTH相关疾病
4.1 原发性甲状旁腺功能亢进
甲状旁腺组织发生自主性病变(如腺瘤、增生或腺癌)可导致PTH过度分泌。过量PTH激活破骨细胞,加速骨质溶解,使骨钙释放增加,引发高钙血症;同时抑制肾小管对磷的重吸收,导致血磷降低。长期高钙血症可引起骨骼疼痛、肾结石、消化系统症状等多系统损害 [7]。
4.2 继发性甲状旁腺功能亢进(SHPT)
继发性甲状旁腺功能亢进(SHPT)常见于慢性肾病(CKD)患者,因肾功能下降导致磷排泄障碍,血磷升高与血钙结合形成沉积,引发低钙血症;同时肾脏合成1,25-二羟维生素D减少,肠道钙吸收降低,进一步加重低钙。低钙持续刺激甲状旁腺增生,导致PTH代偿性分泌增加,形成恶性循环 [8]。
4.3 术后甲状旁腺功能减退
甲状腺或甲状旁腺手术中,甲状旁腺因直接损伤、血供破坏或意外切除而功能受损,导致PTH分泌不足。PTH缺乏使破骨细胞活性减弱,骨钙动员减少,同时肾小管钙重吸收下降,引发低钙血症,表现为手足搐搦、麻木等症状,长期可导致骨密度异常 [9]。
4.4 PTH抵抗综合征
由PTH1R自身抗体或遗传缺陷导致。自身抗体结合PTH1R胞外域,阻断PTH与受体结合及下游cAMP信号激活,使PTH无法发挥作用,出现低钙血症、高磷血症及PTH升高,患者表现为肌肉痉挛、感觉异常等 [5]。
5. PTH靶点药物近期研究进展
PTH(甲状旁腺激素)靶点药物的研究近年来取得了重要进展,涵盖了小分子、抗体和新型作用机制。最近研究聚焦于PTH1R受体的精准调控和PTHrP相关通路的创新治疗。一方面,通过分子动力学模拟锁定PTH1R的机械变构位点,首批兼具强负向变构和信号偏向性的小分子已进入临床前优化阶段,有望突破 GPCR 变构小分子成药瓶颈;另一方面,PTHrP靶向抗体BGM-2121以N端(1-34)为表位,在胰腺癌模型中同步抑制肿瘤生长、逆转高钙血症和恶病质,已完成安全性/药代验证,即将启动临床试验,为PTHrP高表达肿瘤提供全新治疗策略。
6. PTH研究相关产品推荐
华美生物提供PTH重组蛋白、抗体、ELISA试剂盒,助力您PTH相关机制研究及药物开发。
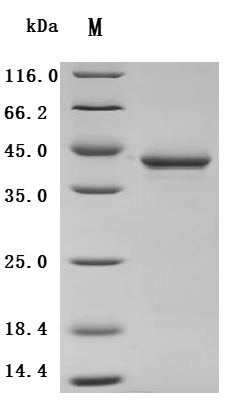
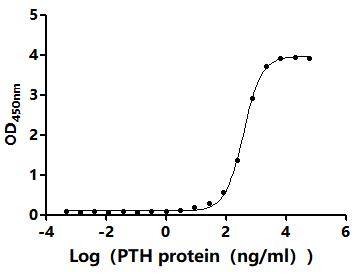
● PTH重组蛋白
Recombinant Macaca fascicularis Parathyroid hormone (PTH) (Active); CSB-MP018987MOV
● PTH抗体

● PTH ELISA试剂盒
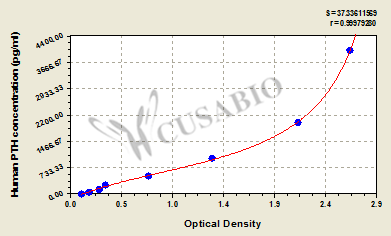
Human Parathyroid hormone,PTH ELISA Kit; CSB-E06934h
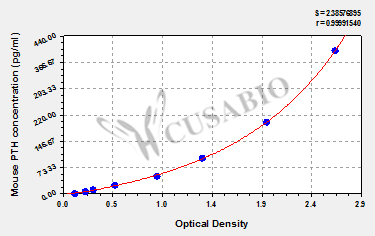
Mouse parathyroid hormone (PTH) ELISA kit; CSB-E08690m
参考文献:
[1] Cavalcante L B C P, Brandão C M Á, Chiamolera M I, et al. Big data-based parathyroid hormone (PTH) values emphasize need for age correction[J]. Journal of Endocrinological Investigation, 2023, 46: 2525-2533.
[2] Starling S. Insights into parathyroid hormone secretion[J]. Nature Reviews Endocrinology, 2020.
[3] Rendina-Ruedy E, Rosen C J. Parathyroid hormone (PTH) regulation of metabolic homeostasis: An old dog teaches us new tricks[J]. Molecular Metabolism, 2022, 60: 101480.
[4] Chen N X, O’Neill K, Moe S M. Uremic Toxin Indoxyl Sulfate (IS) and Parathyroid Hormone (PTH) Interact and Affect Osteocyte Signaling and Function[J]. J Am Soc Nephrol, 2023, 34.
[5] Mandl A, Burbelo P D, Di Pasquale G, et al. Parathyroid Hormone Resistance and Autoantibodies to the PTH1 Receptor[J]. New England Journal of Medicine, 2021, 385(21): 1974-1980.
[6] Mendpara V A, McShane A J, Khan L Z. 7337 High Parathyroid Hormone (PTH) Due To Immunoassay Interference[J]. Journal of the Endocrine Society, 2024, 8(Supplement_1): A226-A227.
[7] Cusano N E, Bilezikian J P. Parathyroid Hormone in the Evaluation of Hypercalcemia[J]. JAMA, 2014, 312(24): 2680-2681.
[8] Block G A, Bushinsky D A, Cheng S, et al. Effect of Etelcalcetide vs Cinacalcet on Serum Parathyroid Hormone in Patients Receiving Hemodialysis With Secondary Hyperparathyroidism: A Randomized Clinical Trial[J]. JAMA, 2017, 317(2): 156-164.
[9] Hashem M, Lim C B, Balasubramanian S P. Postoperative parathyroid hormone (PTH) is equivalent to perioperative PTH drop in predicting postsurgical hypoparathyroidism[J]. Annals of the Royal College of Surgeons of England, 2024, 106: 547-552.



