武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
集落刺激因子1(CSF1)在疾病中的关键作用与靶向治疗新进展
834 人阅读发布时间:2025-06-20 11:52
集落刺激因子1(Colony-Stimulating Factor 1,CSF1),又称巨噬细胞集落刺激因子(M-CSF),是一种关键的细胞因子,在单核巨噬细胞的增殖、分化、存活及功能调控中发挥核心作用。近年来,随着对CSF1及其受体CSF1R(CSF1 Receptor)研究的深入,其在多种生理病理过程中的作用逐渐明晰,为相关疾病的诊断和治疗提供了新的靶点和思路。本文将从CSF1的背景、作用机制、信号通路、相关疾病及靶向药物进展等方面进行综述。
1. 关于CSF1
2. CSF1的作用机制
3. CSF1相关信号通路
4. CSF1相关疾病
5. CSF1靶向药物研究进展
6. CSF1相关产品推荐
1. 关于CSF1
CSF1是一种分泌型糖蛋白,通过与细胞表面的CSF1R(又称CD115)结合发挥生物学效应。CSF1/CSF1R信号轴在免疫系统、骨骼发育、组织修复等生理过程中至关重要。研究表明,CSF1的表达异常与多种疾病的发生发展密切相关。 在正常生理条件下,CSF1主要由成纤维细胞、内皮细胞、肿瘤细胞等分泌,调控巨噬细胞的发育和功能。例如,在肝脏损伤修复过程中,CSF1参与调节肝巨噬细胞(库普弗细胞)的活化和增殖,促进组织修复 [1]。在骨骼系统中,CSF1通过调控破骨细胞的分化,参与骨代谢平衡的维持。
2. CSF1的作用机制
2.1 细胞增殖与分化调控
CSF1与CSF1R结合后,通过激活下游信号通路,促进单核细胞向巨噬细胞的分化,并维持巨噬细胞的存活。在腱鞘巨细胞瘤(Tenosynovial Giant Cell Tumor, TGCT)中,肿瘤细胞因染色体易位(如COL6A3-CSF1融合)导致CSF1过度表达,吸引大量CSF1R阳性的巨噬细胞聚集,形成肿瘤微环境的主要组成部分 [2,3]。这种“旁分泌”效应使得TGCT中巨噬细胞占比高达90%以上,而真正的肿瘤细胞仅为少数。
2.2 肿瘤微环境塑造
在多种实体瘤中,肿瘤细胞分泌的CSF1通过招募和极化巨噬细胞为M2型(促肿瘤表型),促进肿瘤血管生成、免疫抑制和转移。例如,在肝癌中,IL-1β诱导的SLC7A11过表达可通过HIF1α通路上调CSF1表达,进而促进肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs)的浸润和M2极化,加速肝癌转移 [4]。此外,在弥漫大B细胞淋巴瘤(DLBCL)中,CREBBP/EP300突变通过FBXW7-NOTCH-CCL2/CSF1轴,促进TAMs向M2型极化,形成免疫抑制微环境,推动肿瘤进展 [5]。
2.3 免疫调节作用
CSF1参与调控先天性免疫和适应性免疫应答。在哮喘患者中,气道上皮细胞分泌的CSF1水平显著升高,尤其是嗜酸性粒细胞性哮喘。CSF1通过CSF1R-STAT1信号通路,促进气道嗜酸性粒细胞炎症和Th2型免疫反应,加重哮喘症状 [6]。此外,在冠心病中,血液CSF1水平与疾病风险呈正相关,遗传流行病学研究表明,CSF1是冠心病的因果中介因子,其机制可能与CSF1诱导的巨噬细胞活化和动脉粥样硬化斑块形成有关 [7]。
3. CSF1相关信号通路
3.1 1JAK-STAT通路
CSF1与CSF1R结合后,激活受体酪氨酸激酶活性,招募JAK(Janus Kinase)家族激酶,进而磷酸化STAT(Signal Transducer and Activator of Transcription)蛋白。在肝癌中,CSF1/CSF1R信号通过激活STAT1,上调PD-L1和CSF1自身表达,形成正反馈环路,促进肿瘤免疫逃逸和转移 [4]。在巨噬细胞中,STAT3的激活则参与M2型极化的调控。
3.2 PI3K-AKT-mTOR通路
该通路在CSF1介导的巨噬细胞存活和代谢调节中起关键作用。CSF1刺激可激活PI3K,促进AKT磷酸化,进而激活mTOR,调节细胞周期蛋白和抗凋亡蛋白的表达,延长巨噬细胞寿命。在恶性胸腔积液(Malignant Pleural Effusion, MPE)模型中,CSF1/CSF1R通过此通路增强巨噬细胞的血管通透性调节能力,促进积液形成 [8]。
3.3 APK-ERK通路
CSF1信号可激活RAS-RAF-MEK-ERK级联反应,参与巨噬细胞的迁移和功能活化。在TGCT中,虽然肿瘤细胞本身不表达CSF1R,但分泌的CSF1通过激活浸润巨噬细胞的MAPK通路,促进基质金属蛋白酶(如MMP9)的分泌,导致关节软骨破坏 [2,3]。
3.4 其他通路
在DLBCL中,CSF1的异常表达与表观遗传调控异常相关。CREBBP/EP300突变导致H3K27乙酰化水平降低,抑制FBXW7表达,解除对NOTCH通路的抑制,进而上调CCL2和CSF1,形成促肿瘤微环境[5]。这种表观遗传-信号通路的交互作用为DLBCL的发病机制提供了新解释。
4. CSF1相关疾病
4.1 肿瘤性疾病
4.1.1 腱鞘巨细胞瘤(TGCT)
TGCT是CSF1相关疾病的典型代表,其特征是肿瘤细胞存在CSF1基因的染色体易位(如COL6A3-CSF1),导致CSF1过度表达。临床研究表明,CSF1R抑制剂(如pexidartinib、JNJ-40346527)可显著减少TGCT中的巨噬细胞浸润,缩小肿瘤体积,改善患者症状 [2,3]。值得注意的是,TGCT中的肿瘤细胞本身不表达CSF1R,因此CSF1R抑制剂主要通过靶向巨噬细胞发挥作用 [9]。
4.1.2 肝癌(Hepatocellular Carcinoma, HCC)
CSF1在肝癌组织中高表达,通过招募TAMs促进肿瘤进展。研究发现,IL-1β诱导的SLC7A11过表达可通过HIF1α-CSF1轴促进肝癌转移,而阻断CSF1/CSF1R轴可抑制这一过程 [4]。此外,CSF1与PD-L1的共表达与肝癌患者预后不良相关,提示联合阻断CSF1R和PD-1可能是潜在治疗策略。
4.1.3 弥漫大B细胞淋巴瘤(DLBCL)
DLBCL中CREBBP/EP300突变通过FBXW7-NOTCH-CCL2/CSF1轴,促进TAMs向M2型极化,形成免疫抑制微环境。临床数据显示,DLBCL患者中CSF1高表达与不良预后相关,靶向CSF1/CSF1R轴可能成为新的治疗方向 [5]。
4.2 非肿瘤性疾病
4.2.1 哮喘(Asthma)
嗜酸性粒细胞性哮喘患者的气道CSF1水平显著升高,且与嗜酸性粒细胞计数、FeNO(呼出气一氧化氮)等指标正相关。机制研究表明,IL-13和IL-33可诱导气道上皮细胞分泌CSF1,通过CSF1R-STAT1通路促进嗜酸性粒细胞炎症 [6]。靶向CSF1/CSF1R可能为重症哮喘提供新疗法。
4.2.2 急性肝衰竭(Acute Liver Failure, ALF)
ALF患者血清CSF1水平升高,且与预后相关。动物模型显示,CSF1-Fc融合蛋白可通过增强肝巨噬细胞的吞噬和修复功能,改善ALF预后 [1]。CSF1可能作为ALF的预后标志物和潜在治疗靶点。
4.2.3 冠心病(Coronary Artery Disease, CAD)
孟德尔随机化研究证实,血液CSF1是CAD的因果中介因子,遗传预测的CSF1水平每升高1个标准差,CAD风险增加18% [7]。CSF1可能通过调控巨噬细胞在动脉粥样硬化斑块中的浸润和活化,参与CAD的发病。
4.3 其他疾病
CSF1/CSF1R轴还与类风湿关节炎、恶性胸腔积液等疾病相关。例如,在MPE中,CSF1/CSF1R信号介导血管通透性增加和巨噬细胞极化,促进积液形成,CSF1R抑制剂BLZ945可减少MPE体积 [8]。在类风湿关节炎中,CSF1参与滑膜巨噬细胞的活化,推动关节炎症进展 [10]。
5. CSF1靶向药物研究进展
当前,多款CSF1靶向药物处于临床前或临床研究阶段,在不同疾病治疗探索中取得阶段性进展,药物类型包括小分子化药、单克隆抗体等。部分列举如下表:
| 药物 | 作用机制 | 药物类型 | 在研适应症(疾病名) | 在研机构 | 最高研发阶段 |
| 盐酸希美替尼 | FGFRs拮抗剂 | M-CSF抑制剂 | VEGFR2拮抗剂 | 小分子化药 | 转移性食管鳞状细胞癌 | 食管鳞状细胞癌等 | 中国科学院上海药物研究所 | 上海润石医药科技有限公司 | 石药集团有限公司 | 临床3期 |
| AUP1602-C | M-CSF激动剂 | bFGF调节剂 | 工程菌 | 糖尿病足溃疡 | 糖尿病足 | 静脉曲张溃疡 | 褥疮 | 深圳未知君生物科技有限公司 | Aurealis Oy | Aurealis Therapeutics AG | 临床2期 |
| Lacnotuzumab | M-CSF抑制剂 | 单克隆抗体 | 局部晚期黑色素瘤 | Novartis AG | 临床1/2期 |
| DCR-0064 | M-CSF抑制剂 | 小分子化药 | 肿瘤 | 财团法人生物技术开发中心 | 临床1期 |
| Anti-CD115 humanized mAb(Tasly Pharmaceutical Group) | M-CSF抑制剂 | 单克隆抗体 | 肿瘤 | 天士力医药集团股份有限公司 | 临床前 |
6. CSF1相关产品推荐
CSF1/CSF1R轴在生理和病理条件下均发挥重要作用,其异常与多种疾病的发生发展密切相关。从TGCT到肝癌、哮喘等,CSF1的作用机制已逐渐被阐明,为疾病诊断和治疗提供了新靶点。
华美生物提供CSF1研究相关重组蛋白、抗体、ELISA试剂盒产品,助力您的研究。
● CUSABIO CSF1重组蛋白
Recombinant Human Macrophage colony-stimulating factor 1 (CSF1), partial (Active); CSB-MP006043HU1
Recombinant Human Macrophage colony-stimulating factor 1 (CSF1), partial (Active); CSB-YP006043HU1
● CUSABIO CSF1抗体
CSF1 Antibody
CSB-PA06859A0Rb
Csf1 Antibody
CSB-PA07779A0Rb
● CUSABIO CSF1 ELISA试剂盒
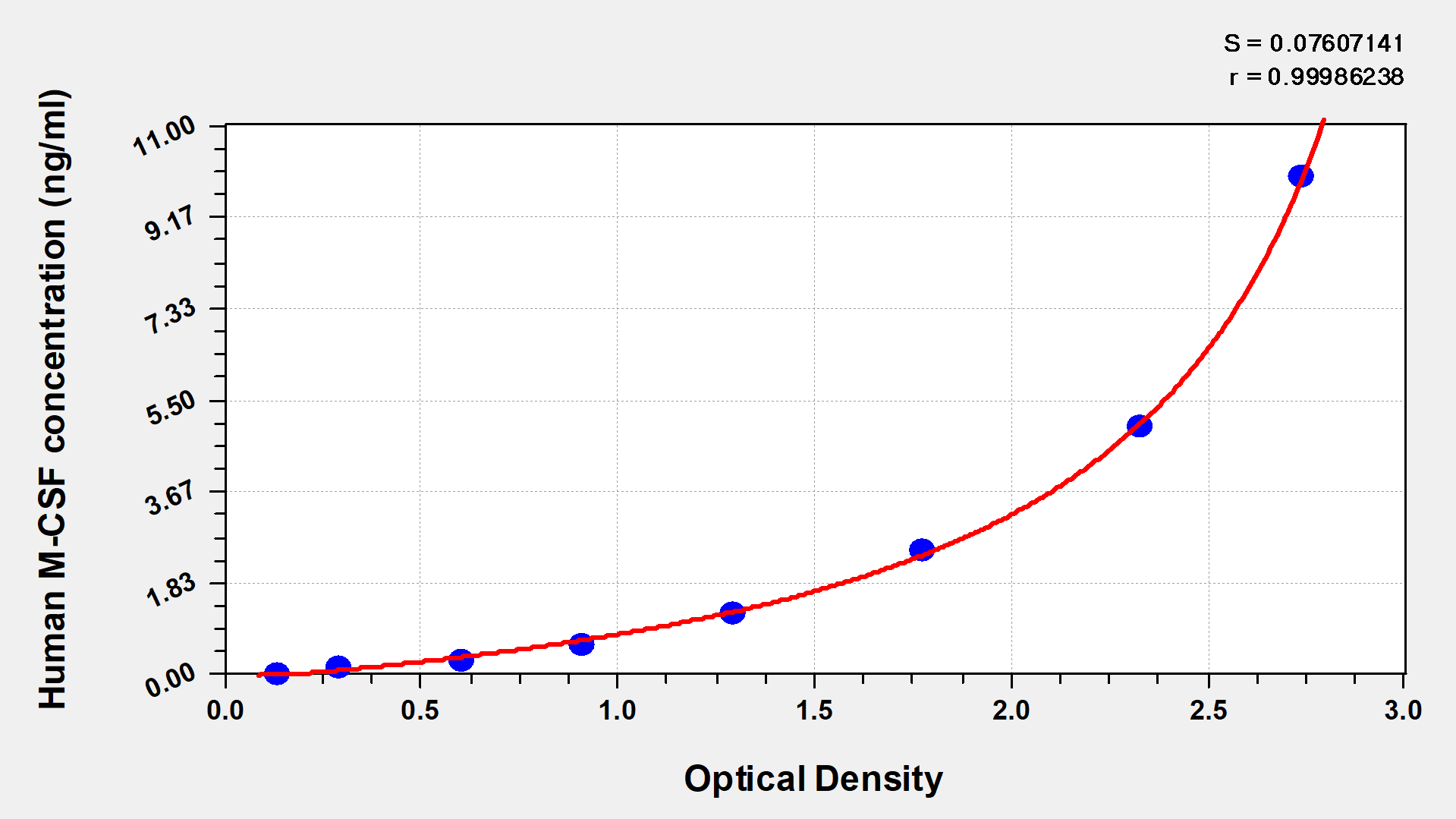
Human Macrophage Colony-Stimulating Factor,M-CSF ELISA kit
CSB-E04658h
Mouse Macrophage Colony-Stimulating Factor,M-CSF ELISA kit
CSB-E04659m
► 请点击查看CSF1相关所有产品
参考文献:
[1] Tacke F, Wynn TA. Biomarker and Therapeutic Potential of CSF1 in Acute Liver Failure. Gastroenterology. 2015.
[2] Serrano C, et al. Safety and efficacy with vimseltinib in patients with tenosynovial giant cell tumor (TGCT) who received no prior anti–colony-stimulating factor 1 (CSF1) therapy: Ongoing phase II study. Annals of Oncology. 2024.
[3] Brahmi M, et al. Complete response to CSF1R inhibitor in a translocation variant of teno-synovial giant cell tumor without genomic alteration of the CSF1 gene. Annals of Oncology. 2018.
[4] Xia L. IL-1b-INDUCED SLC7A11 OVEREXPRESSION FACILITATES HEPATOCELLULAR CARCINOMA METASTASIS THROUGH UPREGULATING PD-L1 AND CSF1 EXPRESSION. AASLD Abstracts.
[5] Huang YH, et al. CREBBP/EP300 mutations promoted tumor progression in diffuse large B-cell lymphoma through altering tumor associated macrophage polarization via FBXW7-NOTCH CCL2CSF1 axis. Signal Transduction and Targeted Therapy. 2021.
[6] Du L, et al. Increased expression of CSF1 in patients with eosinophilic asthma. Immun Inflamm Dis. 2023.
[7] Sjaarda J, et al. Blood CSF1 and CXCL12 as Causal Mediators of Coronary Artery Disease. J Am Coll Cardiol. 2018.
[8] Kosti CN, et al. CSF1/CSF1R signaling mediates malignant pleural effusion formation. JCI Insight. 2022.
[9] van IJzendoorn DGP, et al. Interactions in CSF1-Driven Tenosynovial Giant Cell Tumors. Clin Cancer Res. 2022.
[10] Saleh R, et al. CSF-1 in inflammatory and arthritic pain development. J Immunol. 2018.



