武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
TNFRSF13C(BAFF-R):免疫调节与疾病治疗的关键靶点
283 人阅读发布时间:2025-06-13 10:30
NF-κB 信号通路
MAPK 信号通路
TNFRSF13C激活后,通过与TRAFs相互作用,激活上游激酶,进而激活ERK1/2、JNK和p38等MAPK。ERK1/2主要促进B细胞增殖分化;JNK参与细胞应激反应及存活增殖调控;p38参与炎症反应、细胞骨架重塑等,影响B细胞迁移、定位及细胞周期进程。
PI3K/AKT 信号通路
TNFRSF13C与配体结合后,其胞内结构域与TRAFs 结合,招募PI3K复合物,使其激活并将PIP2转化PIP3。PIP3招募AKT及PDK1至细胞膜,AKT被磷酸化激活后,通过抑制促凋亡蛋白BAD并促进抗凋亡蛋白表达,增强B细胞存活能力,同时促进细胞周期相关蛋白表达,推动细胞周期进程。
免疫缺陷病
● 高IgM血症(HIGM)
● 普通变异型免疫缺陷病(CVID)
● 先天性无丙种球蛋白血症
自身免疫病
● 系统性红斑狼疮(SLE)
● 类风湿关节炎(RA)
● 多发性硬化(MS)
肿瘤疾病
● B细胞淋巴瘤
● 多发性骨髓瘤
● 慢性淋巴细胞白血病
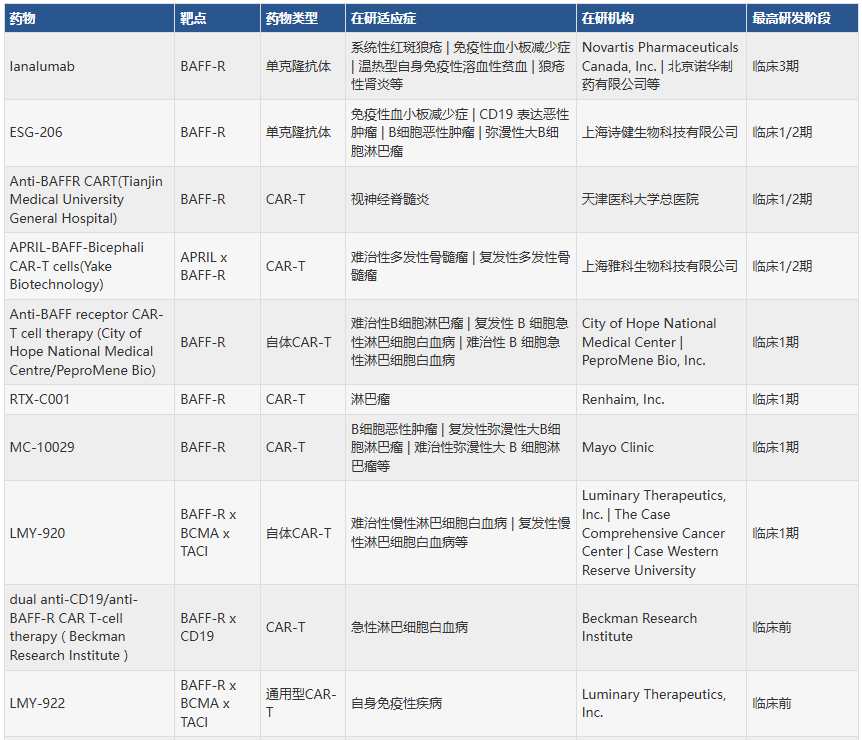
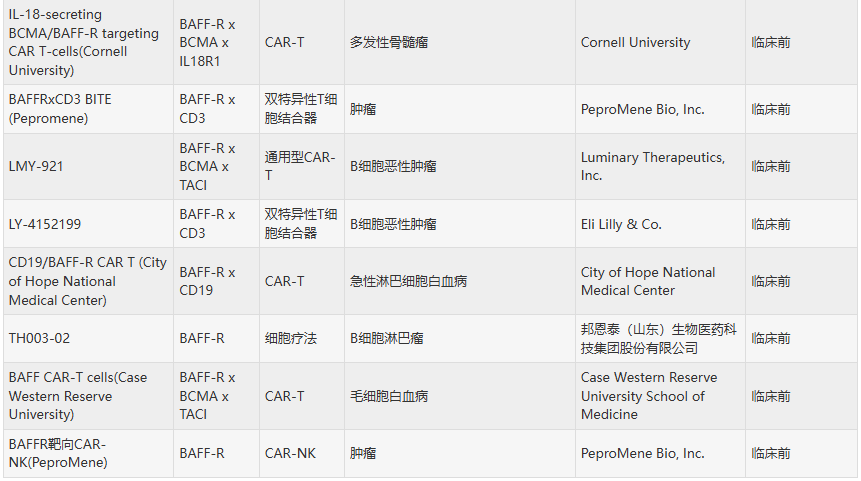
总体来看,TNFRSF13C靶向药物通过抑制B细胞活化和清除异常B细胞,在自身免疫性疾病和B细胞恶性肿瘤中展现出广阔治疗前景。
● TNFRSF13C(BAFF-R)重组蛋白
Recombinant Human Tumor necrosis factor receptor superfamily member 13C (TNFRSF13C), partial (Active); CSB-MP853495HU1

● TNFRSF13C(BAFF-R)抗体
TNFRSF13C Antibody; CSB-PA984896

● TNFRSF13C(BAFF-R)ELISA试剂盒
Mouse Tumor necrosis factor receptor superfamily member 13C(TNFRSF13C) ELISA kit; CSB-EL023972MO
参考文献:
[1] Smulski, C. R., & Eibel, H. (2018). BAFF and BAFF-Receptor in B Cell Selection and Survival. Frontiers in Immunology, 9, 2285.
[2] Sevdali, E., et al. (2021). BAFF receptor polymorphisms and deficiency in humans. Current Opinion in Immunology, 71, 103-110.
[3] Upadia, J., et al. (2018). A previously unrecognized 22q13.2 microdeletion syndrome that encompasses TCF20 and TNFRSF13C. American Journal of Medical Genetics Part A, 176 (12), 2791-2797.
[4] Losi, C. G., et al. (2005). Mutational analysis of human BAFF receptor TNFRSF13C (BAFF-R) in patients with common variable immunodeficiency. Journal of Clinical Immunology, 25 (5), 496-502.
[5] Warnatz, K., et al. (2009). B-cell activating factor receptor deficiency is associated with an adult-onset antibody deficiency syndrome in humans. Proceedings of the National Academy of Sciences, 106 (33), 13945-13950.
[6] Lipsky, P. E., et al. (2022). Biological impact of iberdomide in patients with active systemic lupus erythematosus. Annals of the Rheumatic Diseases, 81 (9), 1136-1142.
[7] Parameswaran, R., et al. (2014). Effector-mediated eradication of precursor B acute lymphoblastic leukemia with a novel fc-engineered monoclonal antibody targeting the BAFF-R. Molecular Cancer Therapeutics, 13 (7), 1567-1577.



