武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
免疫战场的 “侦察兵”:解密 NCR3 靶点
197 人阅读发布时间:2025-06-13 10:00
当前全球肿瘤免疫治疗市场预计2025年超2000亿美元,NCR3作为NK细胞激活“开关”,成为药企必争之地。跨国药企如罗氏、默沙东依托PROTAC技术探索调控,国内药企如药明康德、三生国健加速重组蛋白研发,NCR3靶点正从实验室迈向产业化,掀起研发热潮。
1. NCR3的结构特征
2. NCR3的作用机制
3. NCR3与相关疾病研究
4. 药物研究进展
5. NCR3相关产品
1. NCR3的结构特征
自然细胞毒性触发受体3(Natural Cytotoxicity Triggering Receptor 3,NCR3),又被称为NKp30,其编码基因位于人类主要组织相容性复合体(MHC)Ⅲ类区域 [1]。NCR3属于免疫球蛋白超家族(IgSF)的Ⅰ型跨膜受体,由190个氨基酸组成,分子量约为30kDa。从结构组成来看,NCR3包含一个138个氨基酸长度的胞外免疫球蛋白样结构域,该结构域由两个反平行的β-折叠通过二硫键相连,其中含有两个潜在的N-连接糖基化位点,这对于配体结合至关重要 [2]。NCR3中间部分为19个氨基酸长度的跨膜结构域,此结构域含有一个带正电的精氨酸残基,能够与免疫受体酪氨酸激活基序(ITAM)衔接分子 CD3ζ和FcεRIγ跨膜结构域中的带负电天冬氨酸残基相互作用,这也是其他自然杀伤(NK)细胞活化受体的常见特征。NCR3还具有一个33个氨基酸长度的胞质尾区,该区域缺乏典型的ITAM共有序列。
2. NCR3的作用机制
2.1 激活NK细胞杀伤活性
NCR3主要表达于成熟NK细胞的细胞膜表面,作为NK细胞的一种活化受体发挥关键作用。当NCR3与肿瘤细胞或病毒感染细胞分泌或表达的多种非MHC配体结合时,例如硫酸乙酰肝素糖胺聚糖(HS GAGs)和B7-H6等 [2] ,会触发一系列细胞内信号转导事件:NCR3与配体结合后,通过跨膜结构域与CD3ζ和FcεRIγ等ITAM衔接分子相互作用,招募并激活脾酪氨酸激酶(Syk)和ζ链相关蛋白激酶70(Zap70)。被激活的Syk和Zap70会磷酸化跨膜衔接分子,如T细胞活化连接蛋白(LAT)和非T细胞活化连接蛋白(NTAL),进而激活磷脂酰肌醇-3激酶(PI3K)和磷脂酶C(PLC)等下游信号分子。这些信号转导最终引发钙离子内流,导致细胞骨架重排、细胞毒性颗粒释放以及细胞因子分泌,促使NK细胞对靶细胞发挥杀伤作用,直接裂解肿瘤细胞或被病毒感染的细胞 [3]。
2.2 调节细胞因子分泌
除了直接介导细胞杀伤,NCR3的活化还能调节NK细胞的细胞因子分泌功能。在NCR3与配体结合并激活下游信号通路后,NK细胞会分泌多种细胞因子,如干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)等 [4]。IFN-γ具有广泛的免疫调节作用,能够增强巨噬细胞的吞噬活性和抗原呈递能力,促进Th1细胞分化,同时还能抑制病毒复制和肿瘤细胞生长 [5]。TNF-α则可以诱导肿瘤细胞凋亡,调节免疫细胞的活性和炎症反应。NCR3通过调节这些细胞因子的分泌,在机体的免疫防御和免疫监视过程中发挥着重要的调节作用。
2.3 影响免疫细胞间相互作用
NCR3的功能不仅仅局限于NK细胞自身的活化和杀伤,还在免疫细胞间的相互作用中扮演重要角色。例如,NCR3与Bcl-2相关抗凋亡基因6(BAG-6,也称为 BAT3)结合后,不仅能够促进NK细胞对未获得成熟表型的髓系树突状细胞(DC)的杀伤作用,还能诱导NK细胞释放 TNF-α和IFN-γ,这些细胞因子可以进一步促进DC的成熟。这种免疫细胞间的相互调节有助于构建一个更加有效的免疫应答网络,增强机体对病原体和肿瘤细胞的免疫防御能力。
3. NCR3与相关疾病研究
3.1 NCR3与肿瘤
3.1.1 肿瘤免疫逃逸与NCR3
肿瘤细胞常常会发展出多种机制来逃避机体的免疫监视,其中就包括对NK细胞功能的抑制。部分肿瘤细胞能够表达一些配体,与NK细胞表面的抑制性受体结合,抑制NK细胞的活性。然而,NCR3在肿瘤免疫中具有独特的作用。研究发现,肿瘤细胞表达的B7-H6作为NCR3的配体,在众多实体瘤中呈现高表达,如在结直肠癌(CRC)中的阳性率可达98%,胃癌(GC)中的阳性率为77%,胰腺导管腺癌(PDAC)中的阳性率为63% [2]。肿瘤细胞通过表达B7-H6与NK细胞表面的NCR3结合,理论上可以激活NK细胞对肿瘤细胞的杀伤作用。但在实际肿瘤微环境中,肿瘤细胞可能通过多种方式干扰NCR3介导的免疫激活,导致免疫逃逸。例如,肿瘤微环境中的免疫抑制因子可能抑制NK细胞表面NCR3的表达或功能,使得NK细胞无法有效识别和杀伤肿瘤细胞。
3.1.2 NCR3作为肿瘤治疗靶点的潜力
鉴于NCR3在肿瘤免疫中的重要作用,其成为肿瘤免疫治疗的一个潜在靶点。通过增强NCR3介导的NK细胞活性,有望打破肿瘤的免疫逃逸,提高机体对肿瘤细胞的免疫杀伤能力。目前,针对NCR3的治疗策略主要包括使用单克隆抗体来增强NCR3与配体的结合活性,或者通过基因治疗等手段上调NK细胞表面NCR3的表达。在一些临床前研究中,已经观察到通过靶向NCR3能够增强NK细胞的抗肿瘤活性,抑制肿瘤生长并延长动物模型的生存期 [6]。未来,以NCR3为靶点的肿瘤免疫治疗药物有望为肿瘤患者带来新的治疗选择。
3.2 NCR3与感染性疾病
3.2.1 病毒感染与NCR3
NCR3在机体抵御病毒感染的过程中发挥着重要作用。例如,在痘苗病毒感染时,靶细胞对NK细胞裂解的敏感性会显著增加,研究表明这种对靶细胞变化的识别依赖于自然细胞毒性受体NKp30(即 NCR3)、NKp44和NKp46 [4]。人类巨细胞病毒的主要被膜蛋白pp65能够通过与NCR3相互作用,抑制NK细胞的细胞毒性,这也从反面说明了NCR3在抗病毒免疫中的关键地位 [7]。在慢性丙型肝炎患者中,与健康人和乙型肝炎病毒感染受试者相比,表达NKp46和NKp30的NK细胞比例显著降低,提示NCR3表达的改变可能与病毒感染的慢性化进程相关 [8]。
3.2.2 NCR3在抗感染免疫中的作用机制
当病毒感染细胞后,感染细胞会表达一些异常的分子或改变自身的分子表达模式,这些变化可以被NCR3识别。NCR3与感染细胞表面相应配体结合后,激活NK细胞的杀伤活性,促使NK细胞裂解被病毒感染的细胞,从而阻止病毒在体内的复制和传播。NCR3的活化还能促进NK细胞分泌细胞因子,如IFN-γ等,这些细胞因子可以进一步调节机体的免疫反应,增强其他免疫细胞对病毒感染细胞的清除能力。通过深入研究NCR3在抗感染免疫中的作用机制,有助于开发针对病毒感染性疾病的新的免疫治疗策略。
3.3 NCR3与自身免疫性疾病
在自身免疫性疾病,如类风湿关节炎和多发性硬化症中,免疫系统会错误地攻击自身健康组织,导致炎症和组织损伤。研究发现,NK细胞在这些自身免疫性疾病的发病机制中扮演着重要角色,而NCR3作为NK细胞的活化受体,其功能状态可能影响疾病的进程。理论上,抑制NCR3的活性可能会降低NK细胞的功能,从而减轻免疫系统对自身组织的攻击,缓解炎症症状并阻止疾病进展。相关研究表明,通过调节NCR3的活性,可以在一定程度上调节NK细胞在自身免疫性疾病中的功能,为这类疾病的治疗提供了新的思路 [9]。然而,目前对于NCR3在自身免疫性疾病中的具体作用机制仍有待进一步深入研究,以确定其作为治疗靶点的可行性和安全性。
4. 药物研究进展
目前,以NCR3为靶点的药物研发聚焦于肿瘤免疫治疗与感染性疾病调控两大前沿领域,部分小分子及生物制剂已进入临床验证阶段。靶向NCR3的激动型抗体(如NCR3-Agonist-01)与过继性T细胞疗法联用可显著增强NK细胞及T细胞对实体瘤的杀伤活性,尤其在黑色素瘤、非小细胞肺癌等难治性肿瘤中展现出持久应答潜力;而拮抗型NCR3抗体(如NCR3-Antag-02)在脓毒症及慢性病毒感染模型中,通过抑制过度激活的免疫细胞释放促炎因子,有效降低了组织损伤风险。当前研究重点聚焦于优化抗体Fc段工程化改造以平衡疗效与安全性,并探索NCR3激动剂与PD-1/L1抑制剂、CAR-T细胞疗法的协同机制。此外,基于NCR3信号通路的双特异性抗体及细胞因子融合蛋白亦处于早期开发阶段,未来有望为免疫逃逸型肿瘤及免疫风暴相关疾病提供新型治疗策略。
| 药物 | 药物类型 | 在研适应症 | 在研机构 | 最高研发阶段 |
| NCR-300 | 自然杀伤细胞疗法 | 急性髓性白血病 | 复发性骨髓增生异常综合征 | 难治性骨髓增生异常综合征 | 骨髓增生异常综合征 | 造血干细胞移植 | 安徽中盛溯源生物科技有限公司 | 临床1/2期 |
| BI-765049 | 双特异性T细胞结合器 | 结肠癌 | 胰腺导管腺癌 | 直肠癌 | 胃癌 | 头颈部肿瘤 | 肝癌 | 非小细胞肺癌 | 胰腺癌 | 晚期恶性实体瘤 | 转移性结直肠癌 | Boehringer Ingelheim GmbH | Boehringer Ingelheim International GmbH | 临床1期 |
| IAN-0982 | 双特异性NK细胞接合器 | 实体瘤 | 盛禾(中国)生物制药有限公司 | 药物发现/临床前 |
| CTX-8573 | 三特异性NK细胞结合器 | 多发性骨髓瘤 | Compass Therapeutics, Inc. | 药物发现/临床前 |
| CTX-4419 | 双特异性抗体 | 多发性骨髓瘤 | Compass Therapeutics LLC | Compass Therapeutics, Cambridge, MA, USA | 药物发现/临床前 |
5. NCR3相关产品
NCR3作为NK细胞表面重要的活化受体,其独特的结构赋予了它在免疫调节中的关键作用。通过深入了解NCR3的结构、作用机制以及与相关疾病的关联,为开发针对肿瘤、感染性疾病和自身免疫性疾病等多种疾病的新型治疗策略提供了坚实的理论基础。华美生物提供NCR3相关高质量蛋白和抗体,为广大科研工作者研究助力。
● NCR3蛋白
Recombinant Human Natural cytotoxicity triggering receptor 3 (NCR3), partial (Active); CSB-MP015551HU1
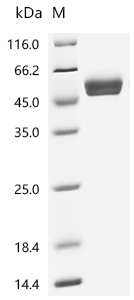
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
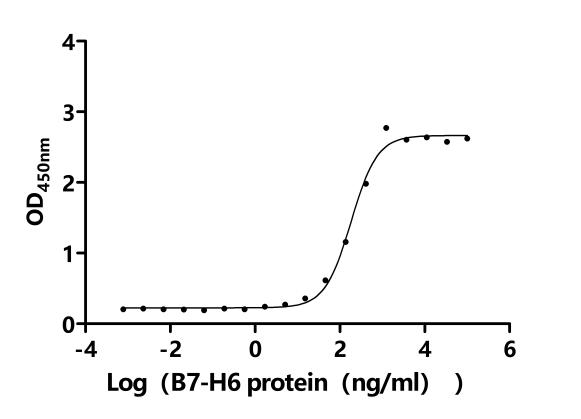
Activity: Measured by its binding ability in a functional ELISA. Immobilized Human NCR3 at 5 μg/ml can bind human NCR3LG1(CSB-MP737873HU-B). The EC50 is 111.3-303.1 ng/mL.
Recombinant Macaca fascicularis Natural cytotoxicity triggering receptor 3 (NCR3), partial (Active); CSB-MP015551MOV1
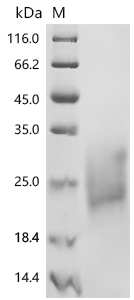
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
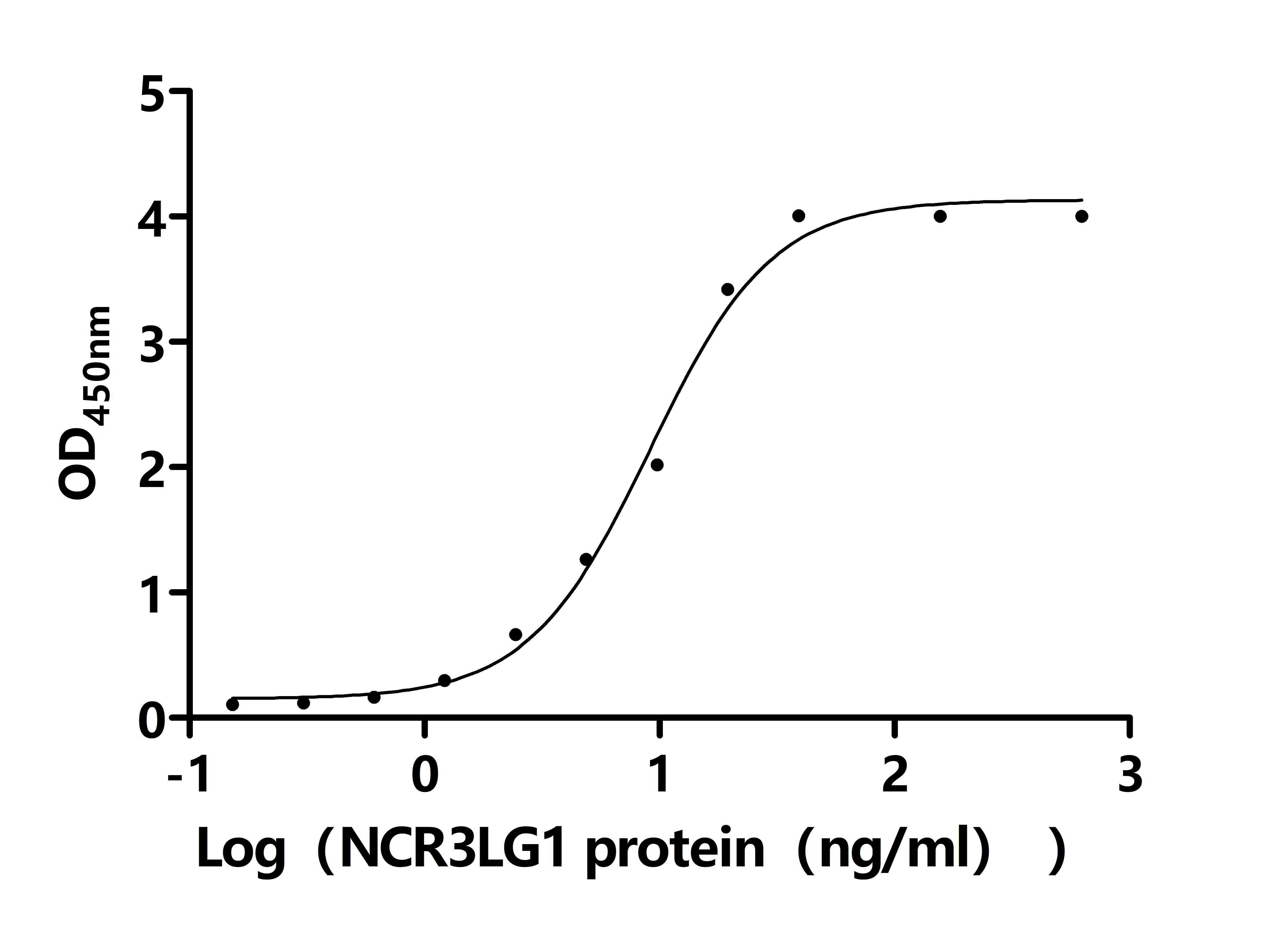
Activity: Measured by its binding ability in a functional ELISA. Immobilized Macaca fascicularis NCR3 at 2 μg/ml on an Nickel Coated plate can bind Macaca fascicularis NCR3LG1(CSB-MP4942MOVd9). The EC50 is 7.429 to 11.19 ng/mL.
● NCR3抗体
NCR3 Antibody; CSB-PA015551LA01HU
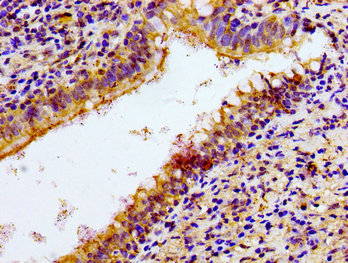
Immunohistochemistry of paraffin-embedded human lung cancer using CSB-PA015551LA01HU at dilution of 1:100
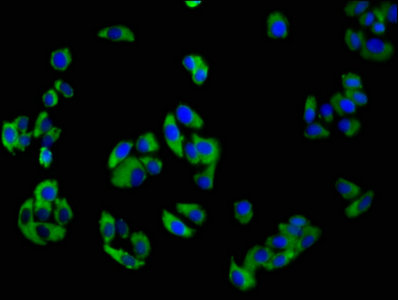
Immunofluorescence staining of HepG2 cells with CSB-PA015551LA01HU at 1:100, counter-stained with DAPI. The cells were fixed in 4% formaldehyde, permeabilized using 0.2% Triton X-100 and blocked in 10% normal Goat Serum. The cells were then incubated with the antibody overnight at 4°C. The secondary antibody was Alexa Fluor 488-congugated AffiniPure Goat Anti-Rabbit IgG(H+L).
参考文献:
[1] Moretta A, Bottino C, Vitale M, et al. Activating receptors and coreceptors involved in human natural killer cell-mediated cytolysis[J]. Annual review of immunology, 2001, 19(1): 197-223.
[2]Brandt C S, Baratin M, Yi E C, et al. The B7 family member B7-H6 is a tumor cell ligand for the activating natural killer cell receptor NKp30 in humans[J]. Journal of Experimental Medicine, 2009, 206(7): 1495-1503
[3] von Strandmann E P, Simhadri V R, von Tresckow B, et al. Human leukocyte antigen-B-associated transcript 3 is released from tumor cells and engages the NKp30 receptor on natural killer cells[J]. Immunity, 2007, 27(6): 965-974.
[4] Sivori S, Vitale M, Morelli L, et al. p46, a novel natural killer cell–specific surface molecule that mediates cell activation[J]. The Journal of experimental medicine, 1997, 186(7): 1129-1136.
[5] Koch J, Steinle A, Watzl C, et al. Activating natural cytotoxicity receptors of natural killer cells in cancer and infection[J]. Trends in immunology, 2013, 34(4): 182-191.
[6] Fend L, Rusakiewicz S, Adam J, et al. Prognostic impact of the expression of NCR1 and NCR3 NK cell receptors and PD-L1 on advanced non-small cell lung cancer[J]. Oncoimmunology, 2017, 6(1): e1163456.
[7] Arnon T I, Achdout H, Levi O, et al. Inhibition of the NKp30 activating receptor by pp65 of human cytomegalovirus[J]. Nature immunology, 2005, 6(5): 515-523.
[8] Li H J, Yang N, Mu X, et al. Reduction of natural killer cells is associated with poor outcomes in patients with hepatitis B virus-related acute-on-chronic liver failure[J]. Hepatology International, 2022, 16(6): 1398-1411.
[9] Gao B. Identification of feature autophagy-related genes and DNA methylation profiles in systemic lupus erythematosus patients[J]. Medical science monitor: international medical journal of experimental and clinical research, 2021, 27: e933425-1.



