武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
DLL4:血管生成调控的关键靶点
189 人阅读发布时间:2025-05-30 10:53
近日,科望医药与CompassTherapeutics公司宣布,VEGF/DLL4双抗tovecimig(CTX-009/ES104)用于二线胆道癌治疗的2/3期临床试验达到主要终点,tovecimig联合方案有望成为全球胆道癌二线治疗的新标准,为患者带来新的希望。
Delta-likeligand4(DLL4)作为Notch信号通路的关键配体,在血管生成与重塑中发挥着核心作用。DLL4的异常表达与多种病理状态下的血管异常生成密切相关,如肿瘤、视网膜病变及心血管疾病等。研究表明,DLL4不仅是血管生成的重要调控因子,其异常调控还可能通过影响内皮细胞行为参与疾病进展,因此成为近年来疾病治疗的研究热点。
1. DLL4的作用机制与信号通路
1.1 DLL4-Notch信号对血管生成的调控
DLL4通过激活Notch信号抑制内皮细胞过度sprouting,维持血管分支的平衡。在生理状态下,DLL4主要高表达于血管内皮细胞的tip细胞,通过旁分泌作用与相邻细胞的Notch受体结合,抑制其tip细胞特性,促进stalk细胞分化,从而维持血管分支的平衡,避免血管过度分支 [2]。然而,在病理条件下,如肿瘤微环境中,DLL4的表达上调。一方面,通过激活Notch信号通路,DLL4能够抑制血管生成,但另一方面,这种异常的信号激活也可能导致异常血管结构的形成,进而促进肿瘤的进展 [1]。
1.2 与其他信号通路的交互作用
- VEGF通路:能够诱导DLL4的表达,二者之间形成负反馈调节环路。当DLL4被抑制时,会导致VEGF驱动的血管过度生成,这表明DLL4与VEGF在血管生成过程中存在着协同调控的关系,共同维持血管生成的平衡 [1]。
- YAP-DLL4-Notch轴:研究发现,在缺氧条件下,AFAP1L1通过HIF-1α激活,进而抑制YAP的磷酸化,促进DLL4的表达,激活Notch信号通路,从而调控内皮细胞的tip细胞行为,影响血管的生成与重塑 [8]。
- KLF13-DLL4-Notch2轴:在肌肉萎缩模型中,KLF13能够通过抑制DLL4-Notch2信号通路,减轻肌肉萎缩的症状,这揭示了DLL4在肌肉代谢与血管交互作用中的新功能,提示DLL4不仅在血管系统中发挥作用,还可能通过与其他组织的相互作用影响机体的代谢过程 [9]。
1.3 细胞内调控机制
DLL4的表达受到多种转录因子和表观遗传机制的调控。例如,在糖尿病模型中,糖皮质激素通过抑制MYOD1介导的转录激活,进而下调KLF13,间接促进DLL4的表达。此外,泛素化途径,如FBXW7介导的降解,也参与了DLL4蛋白水平的调控,影响其在细胞内的稳定性和功能发挥 [9]。
2. 相关疾病
2.1 肿瘤
- 促肿瘤血管生成:在多种肿瘤中高表达,如结直肠癌、肺癌、肝癌等。通过激活Notch信号通路,DLL4能够抑制正常的血管生成,形成异常的血管网络,为肿瘤的生长和转移提供有利条件。以结肠癌为例,DLL4的高表达与肿瘤微血管密度的增加以及预后不良密切相关 [11,12]。临床前研究发现,抗DLL4抗体能够抑制小鼠模型中肿瘤血管的异常分支,但需要注意的是,长期抑制DLL4可能会诱发血管肉瘤等毒性反应 [1]。
- 耐药性:在贝伐珠单抗治疗的结肠癌患者中,DLL4表达的升高与治疗抵抗现象相关,这表明DLL4可能作为抗血管生成治疗耐药的生物标志物,为临床治疗方案的调整提供了潜在的参考依据 [11,12]。
- 免疫逃逸:还能够通过调控肿瘤相关巨噬细胞的极化,促进免疫抑制微环境的形成,从而增强肿瘤的免疫逃逸能力,使得肿瘤细胞能够躲避机体免疫系统的攻击,进一步促进肿瘤的进展。
2.2 视网膜病变
- 早产儿视网膜病变(ROP):在缺氧诱导的视网膜病变模型中,DLL4的缺失会导致血管过度生成,而激活Notch信号通路则可以减少异常新生血管的形成,这说明DLL4在视网膜血管生成的调控中发挥着重要作用,其异常表达与ROP的发生发展密切相关 [5,8]。
- 糖尿病视网膜病变(DR):高血糖环境通过HIF-1α上调内皮细胞中DLL4的表达,进而促进异常血管生成和血管渗漏。研究发现,抑制DLL4的活性能够减轻视网膜水肿,改善血管屏障功能,为DR的治疗提供了新的潜在靶点 [5,8]。
- 年龄相关性黄斑变性(AMD):在湿性AMD患者的脉络膜新生血管中,DLL4呈现高表达状态。通过激活Notch信号通路,DLL4能够促进血管内皮细胞的异常迁移和管腔形成,从而在AMD的病理过程中发挥作用 [5]。
2.3 心血管疾病
- 动脉粥样硬化:棕榈酸通过激活巨噬细胞的 DLL4-Notch 信号,促进炎症因子(如 IL-6、TNF-α)分泌,加剧动脉粥样硬化斑块的不稳定性和血管内皮的损伤,这表明DLL4在代谢性血管损伤中具有关键作用,可能成为动脉粥样硬化治疗的潜在靶点 [13]。
- 血管重塑:在血管损伤模型中,DLL4能够调控平滑肌细胞的表型转换,使其从收缩型向合成型转变,从而参与血管狭窄和新生内膜的形成,影响血管重塑的过程。
- 心肌缺血 / 再灌注损伤:DLL4的缺失能够在一定程度上减轻心肌缺血后的血管内皮凋亡,改善心脏功能,这提示DLL4在缺血性心脏病中可能具有双重调控作用,其在正常生理状态下维持血管稳态,而在病理条件下其异常激活可能加重心脏损伤 [5]。
2.4 慢性肾病
尿毒症毒素吲哚硫酸酯可激活肾小管上皮细胞中的OATP2B1-DLL4轴,诱导巨噬细胞向促炎表型极化,从而加剧肾间质纤维化和肾功能损伤。
2.5 肌肉萎缩与代谢性疾病
在糖尿病和糖皮质激素诱导的肌肉萎缩模型中,KLF13缺失导致DLL4-Notch2信号过度激活,抑制肌细胞分化并促进肌肉蛋白降解。激活KLF13或抑制DLL4可改善肌肉质量和功能 [9]。
2.6 遗传性血管疾病
DLL4基因突变可导致遗传性毛细血管扩张症,表现为皮肤和黏膜血管异常增生,提示DLL4在维持血管稳态中的基础作用 [6]。
3. 药物研究进展
DLL4是Notch信号通路关键配体,调控血管生成与成熟。抗DLL4抗体可抑制肿瘤血管生成,但长期使用可能诱发肝血管肉瘤等毒性,联合抗VEGF药物在小鼠模型中可增强抗肿瘤效果,降低异常血管灌注及耐药风险。目前已有2条DLL4 x VEGF双抗管线在研,最高研究阶段处于临床2/3期。在研管线整理如下表:
| 药物 | 作用机制 | 药物类型 | 在研适应症(疾病名) | 在研机构 | 最高研发阶段 |
| Tovecimig | DLL4抑制剂 | VEGF-A抑制剂 | 双特异性抗体 | Vater壶腹癌 | 胆囊癌 | 肝内胆管癌 | 胆道癌 | 结肠癌 | 转移性结直肠癌 | 直肠癌 | 胆管癌 | 转移性胆道癌 | 结直肠癌 | 卵巢癌 | Compass Therapeutics LLC | Compass Therapeutics, Inc. | M.D. Anderson International España SA | BINEX Co., Ltd. | ABL Bio, Inc. | 科望(上海)生物医药科技有限公司 | 科望(苏州)生物医药科技有限公司 | 临床2/3期 |
| Navicixizumab | DLL4抑制剂 | VEGF抑制剂 | 双特异性抗体 | 晚期恶性实体瘤 | 结直肠癌 | 卵巢癌 | 胃癌 | 三阴性乳腺癌 | 输卵管癌 | 原发性腹膜癌 | Oncxerna Therapeutics, Inc. | Mereo BioPharma Group Plc | 临床2期 |
| Anti-DLL4 antibody (Regeneron) | DLL4抑制剂 | 抗体 | 移植物抗宿主病 | Regeneron Pharmaceuticals, Inc. | 临床前 |
4. DLL4相关产品
华美生物提供高活性的DLL4重组蛋白、抗体及ELISA试剂盒产品,助力科研人员开展DLL4机制研究及探索其潜在临床价值。
● DLL4重组蛋白
Recombinant Human Delta-like protein 4 (DLL4),partial (Active); CSB-MP878862HU

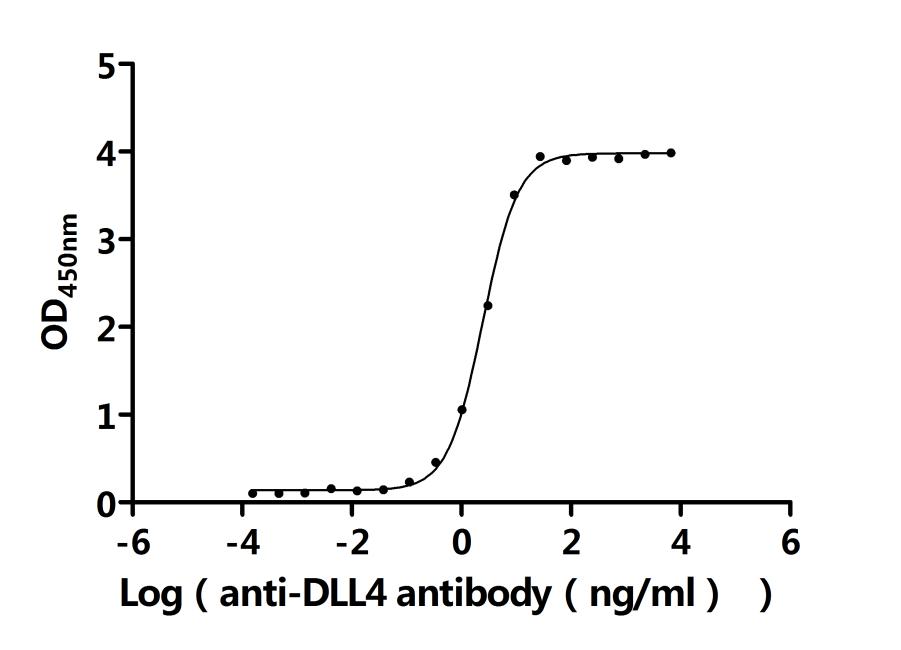
● DLL4抗体
DLL4 (Navicixizumab) Recombinant Monoclonal Antibody
CSB-RA878862MA1HU
Applications: ELISA
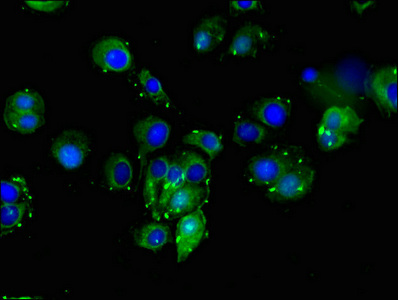
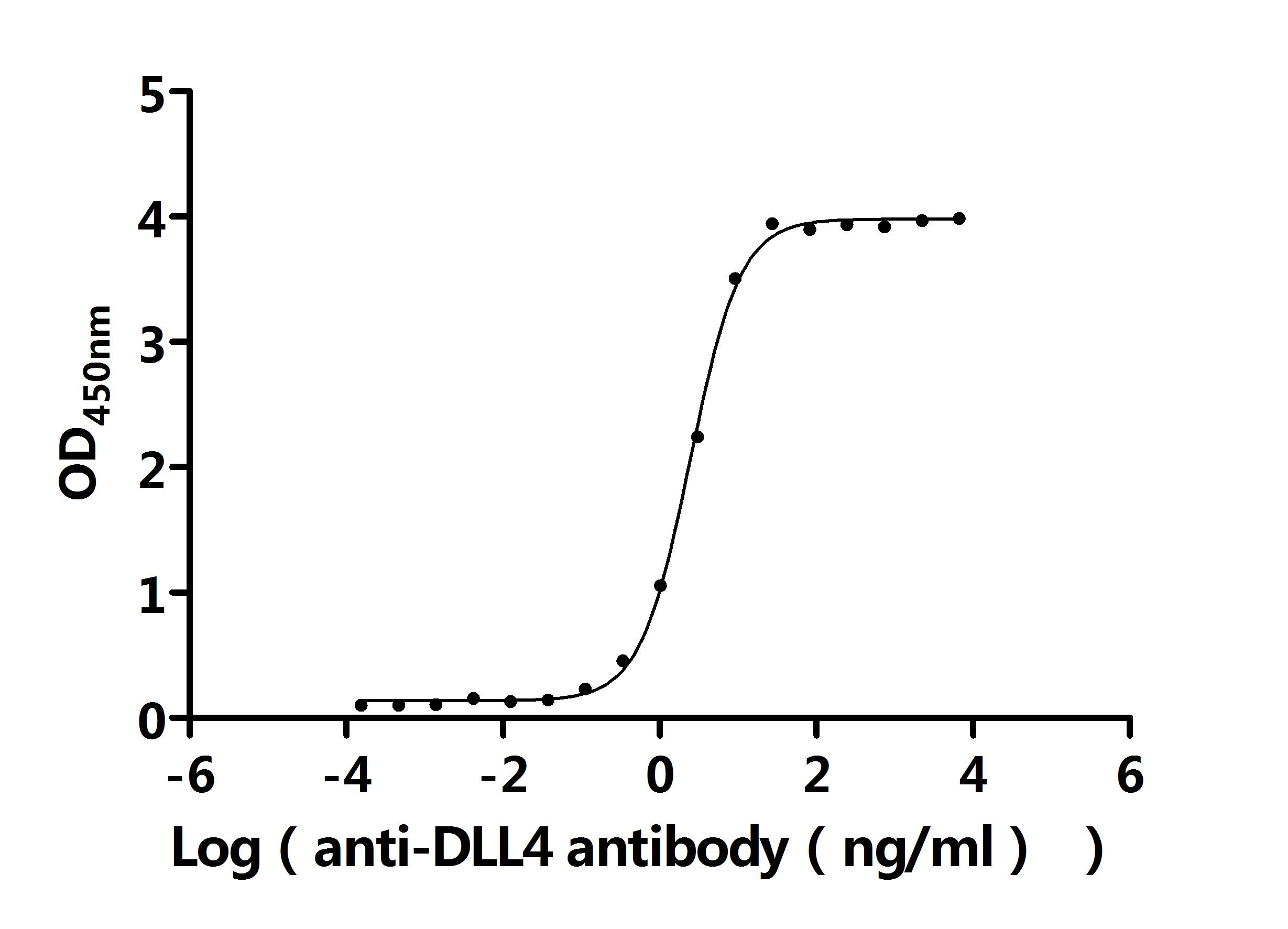
DLL4 Antibody
CSB-PA006949LA01HU
Applications: ELISA, IF
● DLL4 ELISA试剂盒
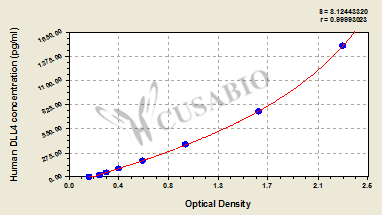
Human Delta-like protein 4(DLL4) ELISA kit
CSB-EL006949HU
参考文献:
[1] Yan M, Callahan CA, Beyer JC, et al. Chronic DLL4 blockade induces vascular neoplasms. Nature. 2010;463(7283):E6-E7. DOI: 10.1038/nature08751.
[2] Pitulescu ME, Schmidt I, Giaimo BD, et al. Dll4 and Notch signalling couples sprouting angiogenesis and artery formation. Nat Cell Biol. 2017;19(8):915-927. DOI: 10.1038/ncb3555.
[3] Folkman J. Angiogenesis: an organizing principle for drug discovery. Nat Rev Drug Discov. 2007;6(4):273-286. DOI: 10.1038/nrd2273.
[4] Bassel-Duby R, Olson EN. Notch signaling in skeletal muscle development and disease. Cold Spring Harb Perspect Biol. 2015;7(10):a019067. DOI: 10.1101/cshperspect.a019067.
[5] Yang JM, Park CS, Kim SH, et al. Dll4 Suppresses Transcytosis for Arterial Blood-Retinal Barrier Homeostasis. Circ Res. 2020;126(6):767-783. DOI: 10.1161/CIRCRESAHA.119.316476.
[6] National Cancer Institute. DLL4 wt Allele. NCI Thesaurus. Published February 8, 2020. DOI: 10.32388/QULVH4.
[7] Hellström M, Phng LK, Hofmann JJ, et al. Dll4 signaling through Notch1 regulates formation of tip cells during angiogenesis. Nature. 2007;445(7129):776-780. DOI: 10.1038/nature05571.
[8] Ren JS, Bai W, Ding JJ, et al. Hypoxia-induced AFAP1L1 regulates pathological neovascularization via the YAP-DLL4-NOTCH axis. J Transl Med. 2023;21(1):651. DOI: 10.1186/s12967-023-04503-x.
[9] Yang S, Xiong LJ, Yang GY, et al. KLF13 restrains Dll4-muscular Notch2 axis to improve muscle atrophy. J Cachexia Sarcopenia Muscle. 2024;15(5):1869-1882. DOI: 10.1002/jcsm.13538.
[10] Noguera-Troise I, Daly C, Papadopoulos NJ, et al. Blockade of Dll4 inhibits tumor growth by promoting nonproductive angiogenesis. Nature. 2006;444(7121):1032-1037. DOI: 10.1038/nature05329.
[11] Jacobsen KS, Holm T, Knoop C, et al. Notch and DLL4 expression in bevacizumab-treated colon cancer patients. Br J Cancer. 2012;107(12):1987-1993. DOI: 10.1038/bjc.2012.628.
[12] Jacobsen KS, Holm T, Knoop C, et al. Notch and DLL4 expression in bevacizumab-treated colon cancer patients [erratum]. Br J Cancer. 2013;108(3):670. DOI: 10.1038/bjc.2012.736.
[13] Li Y, Zhang Y, Wang X, et al. Palmitic acid in type 2 diabetes mellitus promotes atherosclerotic plaque vulnerability via macrophage Dll4 signaling. Atherosclerosis. 2021;327:134-144. DOI: 10.1016/j.atherosclerosis.2021.09.014.



