武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
【直播回放速递】破解蛋白表达"低产/易聚/难折叠"困局!4月23日直播完整回放今日上线
173 人阅读发布时间:2025-04-25 13:21
破解蛋白表达"低产/易聚/难折叠"困局!4月23日直播完整回放今日上线,三大模块直击研究痛点:
🔥 从大肠杆菌到哺乳动物细胞——基于跨膜/修饰/复杂度特性的表达系统决策树
🔥 密码子优化+融合标签双轨策略——兼顾蛋白产量与功能活性的实验方案
🔥 解锁UniProt/NCBI/PDB三大开源数据库——精准获取结构域、亲疏水性等关键参数
下方是观看方式及本次直播的常见问题解答,涵盖包涵体复性全流程设计、载体标签N/C端选择决策树、折叠辅助剂共表达策略等高频疑问,助您快速复现高质量蛋白表达成果!
📌 观看方式:
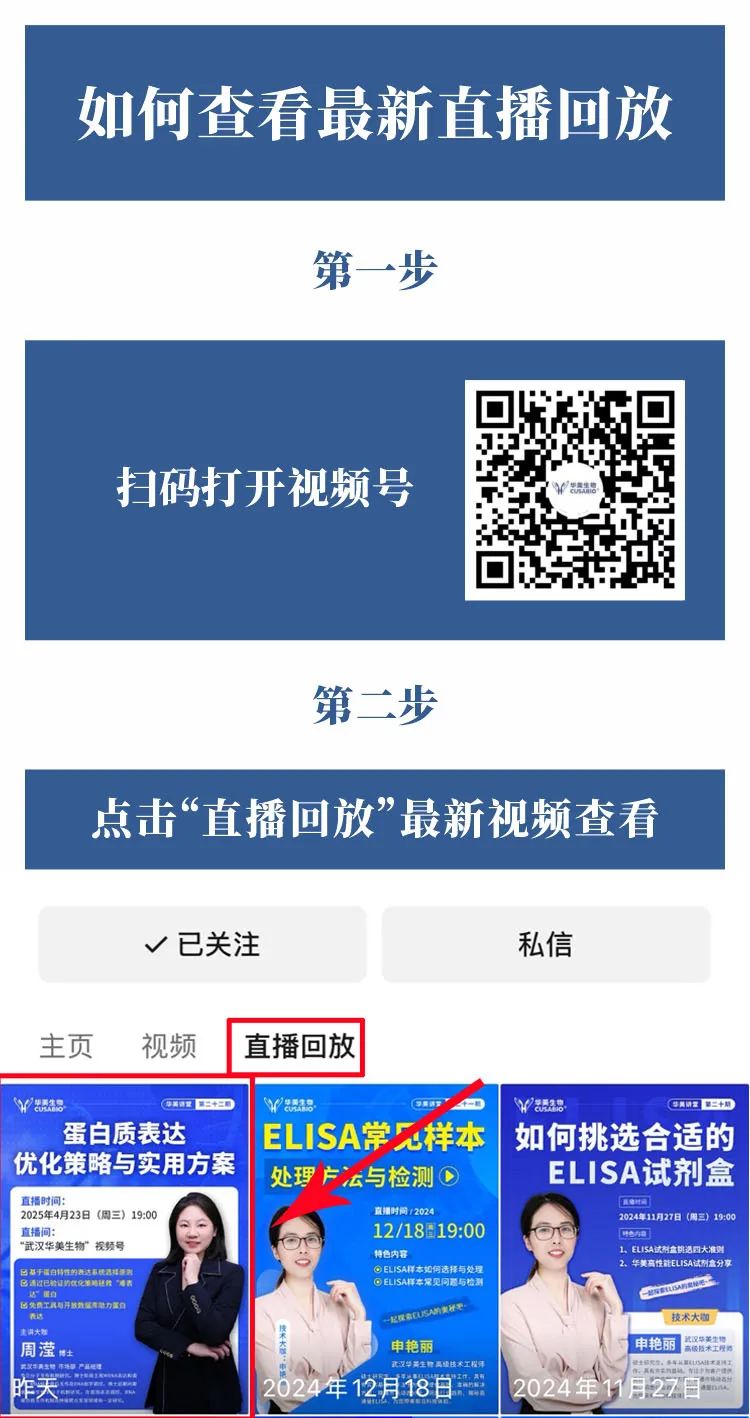
常见问题解答
1.大肠杆菌中表达的蛋白总是聚集成不可溶性包涵体,优化表达策略之后还是不可避免,有什么解决办法?
A:如果包涵体不可避免,可考虑通过包涵体的复性回收蛋白。蛋白复性指的是使目标蛋白从变性的完全伸展状态恢复到正常的折叠结构,同时去使二硫键正常形成。
A: 一般来说会将蛋白标签放在蛋白没有特殊功能结构的那一端,防止增加的标签对目的蛋白造成功能性的影响,所以经常需要根据目的蛋白自身功能域和结构来决定。其他的标签,如比较小的标签蛋白,经常融合到目的蛋白的N端,在不影响蛋白功能的情况下,蛋白纯化会相对容易。但是如果目的蛋白是分泌蛋白,放在N端容易因为蛋白N端的信号肽而被酶切掉,这个情况就比较适合加在C端。
A: 可以先考虑一下降低表达速率,如低温诱导和低浓度诱导剂,给蛋白折叠留出时间,也减少蛋白表达过量造成的堆积;其他的还有添加折叠辅助剂比如共表达分子伴侣;最后也可以考虑优化一下蛋白序列,如果追求的不是全长蛋白的表达,可以考虑删掉疏水区域,只保留核心功能域。
A: 可能的原因之一是蛋白本身的翻译后修饰,如果表达的蛋白是糖基化或磷酸化的,这些修饰会增加蛋白的实际分子量。还有可能的原因是蛋白酶降解而导致多条目的条带或者比预期小很多的条带;也有可能是因为翻译错误,例如密码子突变或提前终止,导致表达的蛋白比预期小。可以考虑借助C端或者N端的标签做个Western Blot,使用特异性抗体确认一下目标蛋白的位置。
A: 如果是酶,一般直接测酶活性,如利用荧光底物进行检测, 荧光共振能量转移(FRET) 是一个比较常用的方法;蛋白的结合活性测定方法有ELISA和SPR/BLI;其他的还有如流式细胞术,检测细胞层面的蛋白结合,细胞增殖/凋亡实验,可以检测蛋白的功能。
如有更多讲座需求,您可以留言@小酷,我们为您安排哦~



