武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
超越PD-1?新兴免疫检查点BTLA的潜力与突破
168 人阅读发布时间:2026-01-09 13:53
免疫检查点抑制剂,尤其是针对PD-1/PD-L1通路的药物,已在肿瘤治疗领域取得突破性进展。然而,其响应率有限、耐药性出现以及在某些适应症中的疗效不足,凸显了探索新靶点以丰富治疗策略的迫切需求。在这一背景下,B和T淋巴细胞衰减器(BTLA)作为结构与功能均具有独特性的抑制性免疫检查点,正受到越来越多的关注。
与PD-1等经典检查点相比,BTLA在配体选择性、信号传导机制(如依赖HVEM的双向信号)以及对各类免疫细胞的调控网络方面展现出明显差异。这些特性是否意味着BTLA可能突破现有疗法的某些局限?其在肿瘤微环境中的上调是否与免疫逃逸新机制相关?而在自身免疫性疾病中,BTLA又是否扮演着独特的保护性角色?
本文将系统解析BTLA的分子基础、信号网络及其在肿瘤、自身免疫病、炎症等多种疾病中的关键作用,并梳理针对该靶点的最近药物研发进展,旨在探讨BTLA是否具备引领下一代免疫治疗创新的潜力。
1. BTLA在免疫调节中的新兴作用
2. BTLA的分子结构、基因定位与表达模式
3. BTLA的信号通路与免疫调节机制
4. BTLA在疾病发生发展中的功能
5. BTLA靶向药物的最近研究进展
6. BTLA研究工具
1. BTLA在免疫调节中的新兴作用
作为B7-CD28家族的重要抑制性免疫检查点,BTLA在T细胞、B细胞、NK细胞及髓系细胞中均有表达,并通过诱导负向信号限制过度免疫反应,维持免疫稳态。与PD-1、CTLA-4等经典检查点相比,BTLA在结构特征、配体选择性及双向信号传导方面具有独特性,使其在肿瘤免疫、自身免疫调控及炎症反应中的作用日益受到重视。越来越多证据表明,BTLA异常表达或信号失衡可能导致免疫耐受受损、免疫耗竭或组织炎症持续,从而驱动多类疾病的发展。因此,系统研究BTLA的结构、信号与功能对设计更精准的免疫治疗策略具有重要意义。
2. BTLA的分子结构、基因定位与表达模式
2.1 BTLA的分子结构与胞内信号基序
BTLA(BandT lymphocyte attenuator)通过其胞内段的ITIM和ITSM基序介导抑制性信号 [1]。ITIM的核心序列包含磷酸化酪氨酸及其后的疏水残基,对SH2结构域的结合至关重要。研究显示BTLA主要通过ITIM招募 SHP1的N端SH2结构域(nSH2),并以此为主导启动抑制信号 [2]。进一步分析表明,ITIM中pY+1位点残基的分子体积对SHP1招募呈钟形依赖关系,BTLA中保守的丙氨酸有助于稳定其与SHP1的特异结合 [2]。
相比之下,PD-1的ITSM是其主要功能基序,通过高亲和力结合SHP2的C端SH2(cSH2)实现选择性招募,而其ITIM因pY+1处存在甘氨酸而对SHP1招募作用较弱。将该甘氨酸替换为丙氨酸可显著增强PD-1与SHP1的结合 [2]。这些差异说明结构上细微的氨基酸变化即可显著影响检查点受体对SHP1/2的选择性,从而决定其免疫抑制效能。
2.2 BTLA的表达模式与调控机制
BTLA在多种免疫细胞中表达,且表达水平受基因调控、表观遗传及细胞内调节因子的多重控制。例如,T细胞谱系蛋白THEMIS可限制BTLA的抑制能力,为T细胞发育提供“调节阈值” [3]。此外,miR-155-5p在CLL B细胞中影响BTLA表达,而在T细胞中则不产生显著影响 [4]。
2.3 BTLA的主要配体HVEM及其多配体网络
BTLA的主要配体为肿瘤坏死因子受体家族成员HVEM(TNFRSF14)[5]。HVEM不仅与BTLA结合,还能与LIGHT、CD160等多种配体相互作用 [6],形成复杂的共刺激与共抑制信号网络。 HVEM-LIGHT/CD160的相互作用可增强 HVEM的共刺激功能,而BTLA-HVEM则以抑制信号为主 [6]。研究提示HVEM/BTLA轴在 RA、AITD等自身免疫病中表达失衡 [7]。此外,该轴可通过顺式或反式结合实现双向信号,顺式复合物可抑制HVEM的共刺激活性而不影响BTLA的抑制功能,反式结合则是调控T细胞活化的主要途径 [8]。
3. BTLA的信号通路与免疫调节机制
3.1 ITIM/ITSM磷酸化与SHP1/SHP2招募
T细胞活化后,BTLA的ITIM与ITSM基序发生磷酸化,从而招募SHP1/2,抑制早期T细胞活化事件 [1]。BTLA主要依赖ITIM招募SHP1,而PD-1更偏向通过ITSM招募SHP2 [2]。
3.2 BTLA对T细胞分化与命运的影响
SHP1/2对初始T细胞向效应型和中央记忆型的分化均具有抑制作用,其中SHP1是主要效应分子 [9]。 BTLA与CD5表达呈反向关系,BTLA信号可调控胸腺和外周T细胞CD5水平,从而影响T细胞对自身抗原的识别阈值 [8]。BTLA缺失会导致RTE细胞引发多器官自身免疫 [8]。在记忆CD8 T细胞形成中,BTLA/HVEM信号具有正向共刺激作用,BTLA可作为反式配体促进HVEM依赖的记忆T细胞发育 [10]。
3.3 对B细胞、NK细胞和巨噬细胞的调控
BTLA在BCR信号调控中具潜在作用并影响B细胞活化。在NK细胞中,BTLA与细胞毒性水平相关,可能影响其在肿瘤中的免疫监视功能 [11]。在巨噬细胞中,BTLA表达与M1/M0浸润模式相关,但其分子机制有待进一步探究。
3.4 与其他免疫检查点的交叉调控
BTLA与PD-1、CTLA-4、TIGIT、LAG-3、TIM-3等共同构成多维免疫调控网络 [12]。其表达差异性和功能特异性提示不同检查点在疾病进程中并非简单冗余。在NSCLC和Sézary综合征中,多检查点受体共同变化但呈现 heterogenous expression pattern [12]。联合靶向策略显示BTLA与CTLA-4、PD-1协同调控免疫耐受,在移植耐受及自身免疫调节中已展现协同效果 [13]。此外,BTLA在肿瘤微环境中的表达可与CD47-巨噬细胞轴相关联,其耗竭性BTLA+CD4 T细胞与免疫逃逸密切相关 [14]。
4. BTLA在疾病发生发展中的功能
4.1 肿瘤免疫逃逸与BTLA
BTLA在多类肿瘤中上调,并与免疫耗竭、疾病进展及不良预后相关。例如:
- NSCLC中BTLA高表达与晚期肿瘤、淋巴侵犯及较差OS/RFS相关 [15]。
- OSCC中BTLA与PD-1/PD-L1、CD96等检查点呈强正相关,参与局部免疫抑制 [16]。
- 前列腺癌中HVEM/BTLA高表达提示不良预后 [17]。
- CLL患者中BTLA升高并与更早治疗时间相关 [10]。
- MF/SS中BTLA与T细胞耗竭密切相关 [12]。
这些证据强调BTLA在肿瘤免疫逃逸中的抑制性作用及其作为潜在治疗靶点的价值。
4.2 BTLA在自身免疫病中的保护作用
在自身免疫病中,BTLA通常发挥抑制性、保护性作用:
- BTLA 590C SNP 与RA易感性相关,突变型BTLA失去抑制IL-2的能力 [11]。
- SLE中HVEM水平下降而BTLA稳定,提示BTLA激动剂可能有治疗潜力 [9]。
- 干燥综合征患者外周血中BTLA/HVEM/CD160共表达显著降低,提示BTLA/HVEM轴紊乱 [18]。
4.3 BTLA在感染性疾病和炎症中的作用
HVEM/BTLA信号在肝损伤、肠道免疫稳态、干细胞分化等过程中发挥重要调控作用,例如:
- HVEM表达的MSCs可抑制免疫反应并促进骨形成 [19]。
- HVEM/BTLA缺失导致DDC肝损伤模型中肝胆修复障碍,并与肠道菌群失调相关 [20]。
4.4 BTLA在心血管疾病与肾炎中的保护作用
- 动脉粥样硬化中BTLA激动剂(3C10)可减少滤泡B2细胞、提高调节性细胞比例、增强斑块稳定性 [21]。
- 在实验性新月体性肾炎中,BTLA缺失加重疾病,而BTLA激动剂可抑制Th1细胞并促进Treg,从而保护肾功能。
5. BTLA靶向药物的最近研究进展
目前,BTLA靶向药物的开发呈现出策略多元化与疾病领域拓展的鲜明趋势。研发主体正通过单克隆抗体、小分子药物、重组蛋白及多肽等多种技术路径探索BTLA靶点的治疗潜力。在疾病应用上,已形成两大明确方向:一是在肿瘤领域,研究最为活跃,尤其是针对淋巴瘤、非小细胞肺癌及黑色素瘤等多种实体瘤的单抗药物,其中君实生物的单抗已处于临床III期阶段;二是在自身免疫性疾病领域,如类风湿关节炎、特应性皮炎等,多个项目已进入临床早期研究阶段。整体来看,BTLA靶向药物正从肿瘤免疫治疗向更广泛的疾病谱延伸,部分在研管线整理如下表:
| 药物 | 药物类型 | 在研适应症 | 在研机构 | 最高研发阶段 |
|---|---|---|---|---|
| 重组人源化抗BTLA单克隆抗体(Shanghai Junshi Biosciences) | 单克隆抗体 | 典型霍奇金淋巴瘤 | 难治性经典霍奇金淋巴瘤 | 广泛期小细胞肺癌 | 局限期小细胞肺癌等 | 上海君实生物医药科技股份有限公司 | 上海市肺科医院 | 临床3期 |
| GS-0272 | 小分子化药 | 类风湿关节炎 | Gilead Sciences, Inc. | 临床1期 |
| 注射用聚乙二醇化重组人血管内皮抑制素 (先声药业) | 重组蛋白 | 转移性非小细胞肺癌 | 山东先声生物制药有限公司 | 中国药科大学 | 江苏先声药业有限公司 | 临床1期 |
| ANB-032 | 单克隆抗体 | 特应性皮炎 | AnaptysBio, Inc. | 临床1期 |
| HFB-200603 | 单克隆抗体 | 晚期恶性实体瘤 | 结直肠癌 | 黑色素瘤 | 非小细胞肺癌 | 肾细胞癌 | 胃癌 | Hifibio SAS | 临床1期 |
| MB-272 | 单克隆抗体 | 自身免疫性疾病 | MiroBio Ltd. | 临床1期 |
| HFB-200604 | 单克隆抗体 | 自身免疫性疾病 | 高诚生物医药(杭州)有限公司 | 临床申请批准 |
| CD160-Derived Peptide A5(University of Gdańsk) | 合成多肽 | 免疫系统疾病 | University of Gdansk | 临床前 |
| MG-B-28 | 小分子化药 | 肿瘤 | Weill Cornell Medicine | Mansoura University | 临床前 |
(数据截止到2025年12月24日,来源于synapse)
6. BTLA研究工具
作为关键的免疫检查点分子,BTLA通过调控免疫细胞的活性来维持免疫稳态,并在肿瘤、自身免疫病、感染等多种疾病的发病机制中扮演核心角色,被视为极具潜力的新一代免疫治疗靶点。武汉华美生物提供BTLA重组蛋白、抗体及ELISA试剂盒产品,助力您进行相关机制研究及靶向药物开发。
● BTLA重组蛋白
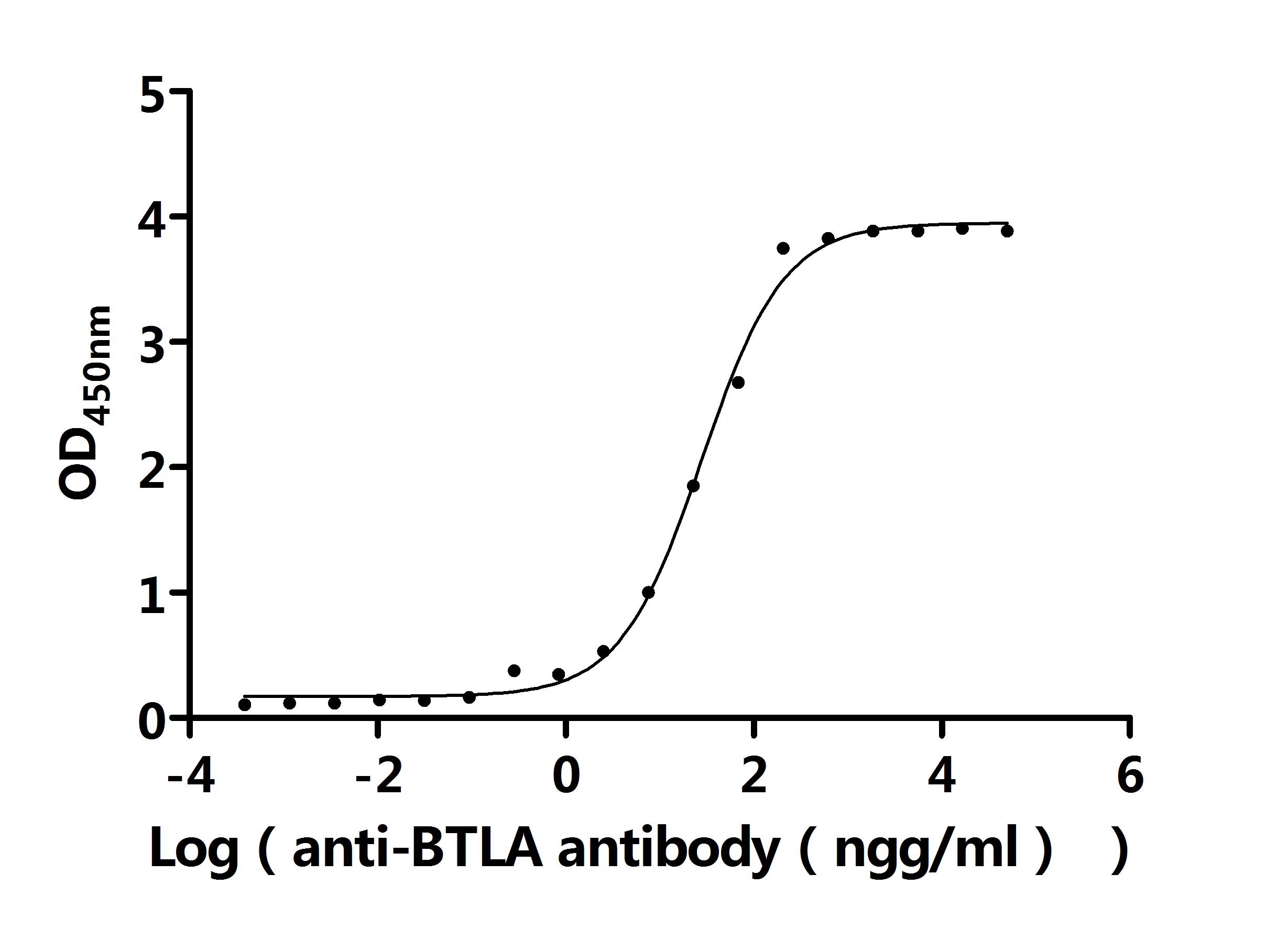
Recombinant Human B- and T-lymphocyte attenuator (BTLA), partial (Active); CSB-MP773799HU
Recombinant Human B- and T-lymphocyte attenuator(BTLA), partial (Active); CSB-MP773799HU1
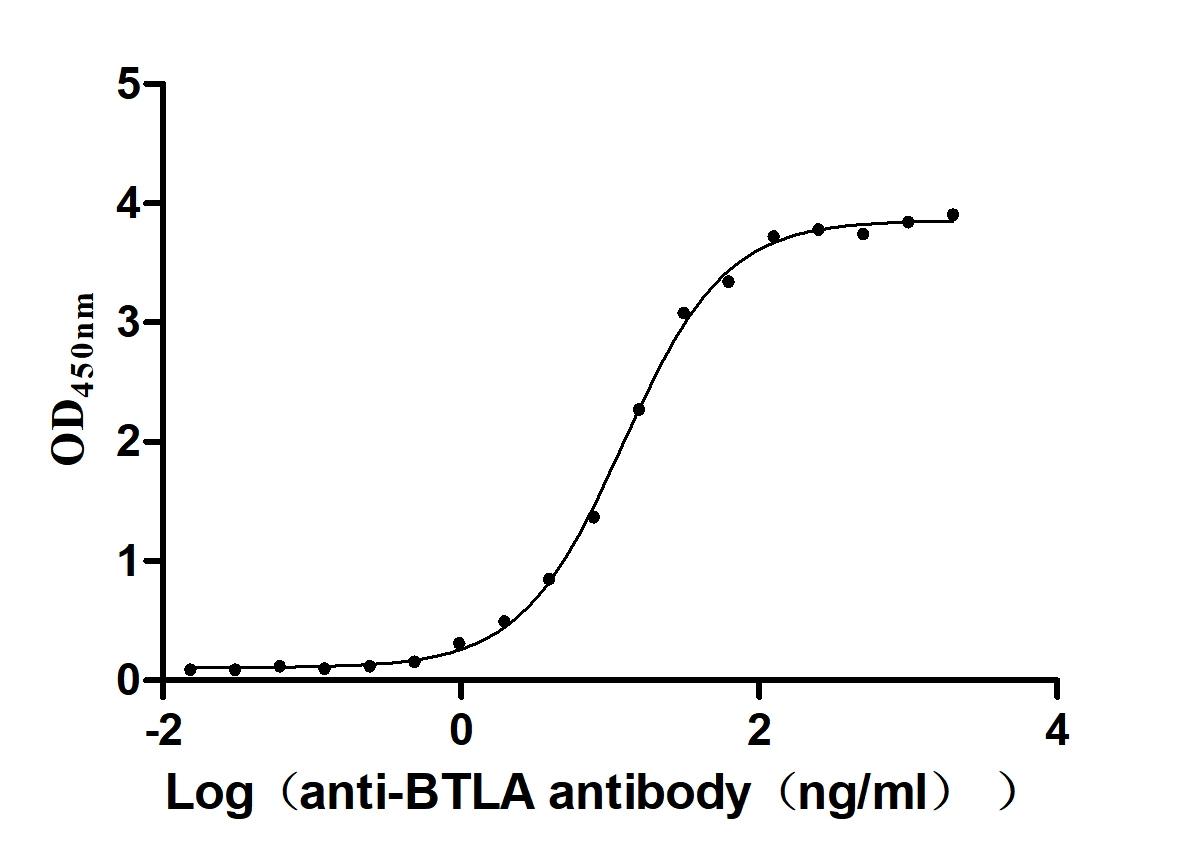
Recombinant Macaca fascicularis B- and T-lymphocyte attenuator (BTLA), partial (Active); CSB-MP4897MOV
● BTLA抗体
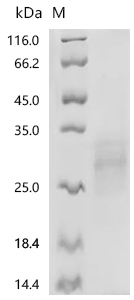
BTLA Recombinant Monoclonal Antibody; CSB-RA773799MA1HU
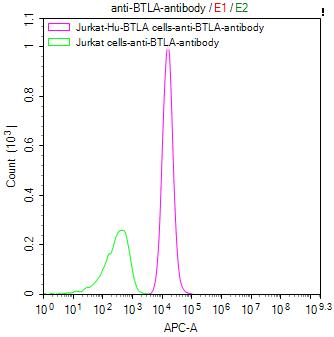
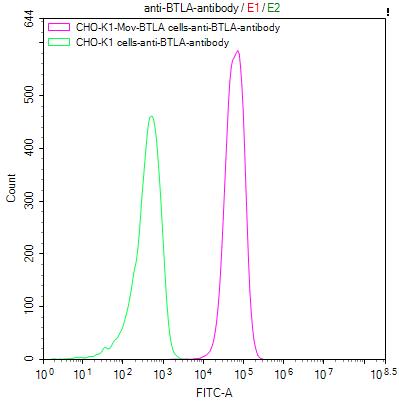
● BTLA ELISA试剂盒
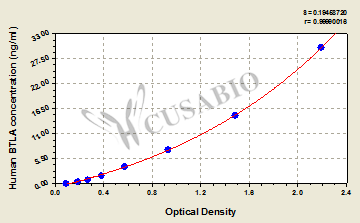
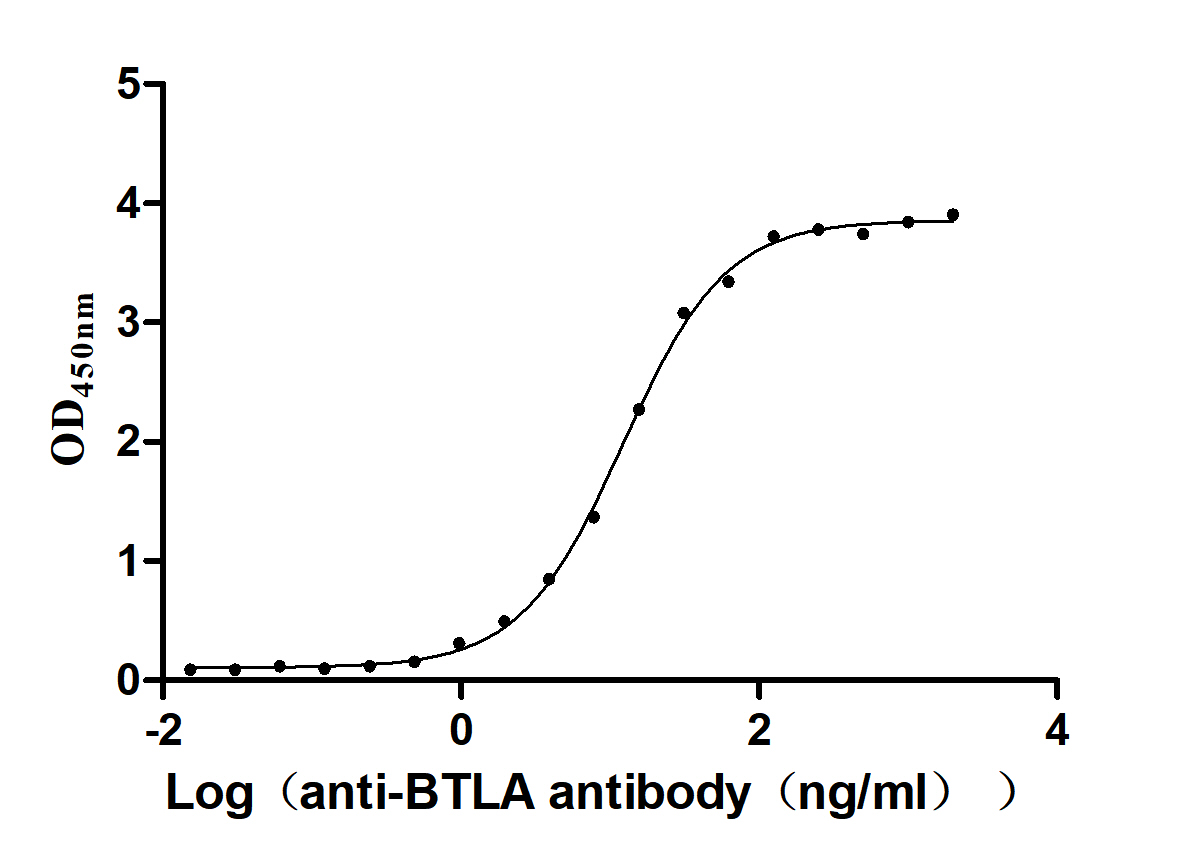
Human B- and T-lymphocyte attenuator(BTLA) ELISA kit; CSB-EL002868HU
参考文献:
[1] P. Guruprasad, A. Carturan, Yunlin Zhang, K. G. Kumashie, et al. Porazzi, M. Ruella.(2023). Modulation of the Btla-HVEM Axis to Enhance CAR T Cell Immunotherapy Against Cancer.
[2] Xiaozheng Xu, T. Masubuchi, Qixu Cai, Yunlong Zhao, E. Hui.(2021). Molecular features underlying differential SHP1/SHP2 binding of immune checkpoint receptors.
[3] Suzanne Mélique, Aurélie Vadel, Nelly Rouquié, Cui Yang, Cyrielle Bories, Coline Cotineau, Abdel Saoudi, N. Fazilleau, Renaud Lesourne.(2024). THEMIS promotes T cell development and maintenance by rising the signaling threshold of the inhibitory receptor BTLA.
[4] A. Kosmaczewska, L. Ciszak, Anna Andrzejczak, A. Tomkiewicz, Anna Partyka, Zofia Rojek-Gajda, Irena Frydecka, Dariusz Wołowiec, Tomasz Wróbel, A. Bojarska-Junak, Jacek Roliński, Lidia Karabon.(2025). miR-155-5p Silencing Does Not Alter BTLA Molecule Expression in CLL T Cells: Implications for Targeted Immunotherapy.
[5] Shane Atwell, T. Cheung, Elaine M Conner, Carolyn Ho, Jiawen Huang, Erin L Harryman, Ricky Lieu, Stacie Lim, Wai W Lin, Diana I Ruiz, Andrew C Vendel, Carl F Ware.(2025). Quantitative detection of the HVEM-BTLA checkpoint receptor cis-complex in human lymphocytes.
[6] Chun Zeng, Tinghe Wu, Y. Zhen, X. Xia, Yong Zhao.(2005). BTLA, a new inhibitory B7 family receptor with a TNFR family ligand.
[7] W. Hobo, W. J. Norde, N. Schaap, H. Fredrix, F. Maas, Karen Schellens, J. Falkenburg, A. Korman, D. Olive, R. van der Voort, H. Dolstra.(2012). B and T Lymphocyte Attenuator Mediates Inhibition of Tumor-Reactive CD8+ T Cells in Patients After Allogeneic Stem Cell Transplantation.
[8] Adeolu O. Adegoke, G. Thangavelu, Ting-Fang Chou, Marcos I. Petersen, K. Kakugawa, J. May, K. Joannou, Qingyang Wang, K. K. Ellestad, Louis Boon, Peter A. Bretscher, H. Cheroutre, Mitchell Kronenberg, T. Baldwin, Colin C. Anderson.(2024). Internal regulation between constitutively expressed T cell co-inhibitory receptors BTLA and CD5 and tolerance in recent thymic emigrants.
[9] Andrew C Vendel, L. Jaroszewski, Matthew D Linnik, Adam Godzik.(2024). B‐ and T‐Lymphocyte Attenuator in Systemic Lupus Erythematosus Disease Pathogenesis.
[10] Christian Sordo-Bahamonde, Seila Lorenzo-Herrero, Alejandra G Martinez-Perez, A. P. Gonzalez-Rodriguez, Á. Payer, E. González-García, Candelaria Aguilar-García, Sara González-Rodríguez, A. López-Soto, A. García-Torre, S. González.(2023). BTLA dysregulation correlates with poor outcome and diminished T cell-mediated antitumor responses in chronic lymphocytic leukemia.
[11] Mie Oki, N. Watanabe, T. Owada, Yoshihiro Oya, K. Ikeda, Y. Saito, R. Matsumura, Y. Seto, I. Iwamoto, H. Nakajima.(2011). A Functional Polymorphism in B and T Lymphocyte Attenuator Is Associated with Susceptibility to Rheumatoid Arthritis.
[12] F. Anzengruber, D. Ignatova, T. Schlaepfer, Yun-Tsan Chang, L. French, S. Pascolo, E. Contassot, M. Bobrowicz, W. Hoetzenecker, E. Guenova.(2019). Divergent LAG-3 versus BTLA, TIGIT, and FCRL3 expression in Sézary syndrome.
[13] W. Truong, J. C. Plester, W. Hancock, S. Merani, T. Murphy, K. Murphy, J. Kaye, C. Anderson, A. M. Shapiro.(2007). Combined Coinhibitory and Costimulatory Modulation with Anti‐BTLA and CTLA4Ig Facilitates Tolerance in Murine Islet Allografts.
[14] J. Chemnitz, R. Parry, K. Nichols, C. June, J. Riley.(2004). SHP-1 and SHP-2 Associate with Immunoreceptor Tyrosine-Based Switch Motif of Programmed Death 1 upon Primary Human T Cell Stimulation, but Only Receptor Ligation Prevents T Cell Activation1.
[15] Xiangmin Li, Zhaoguo Xu, Guoyuan Cui, Li Yu, Xiaoye Zhang.(2020). BTLA Expression in Stage I–III Non–Small-Cell Lung Cancer and Its Correlation with PD-1/PD-L1 and Clinical Outcomes.
[16] Minglei Yang, Chenxi Zheng, Yu Miao, Cuicui Yin, Longfei Tang, Chongli Zhang, Pu Yu, Qingfang Han, Yihui Ma, Shenglei Li, Guozhong Jiang, Wencai Li, Peiyi Xia.(2025). BTLA promoter hypomethylation correlates with enhanced immune cell infiltration, favorable prognosis, and immunotherapy response in melanoma.
[17] N. Aubert, S. Brunel, D. Olive, G. Marodon.(2021). Blockade of HVEM for Prostate Cancer Immunotherapy in Humanized Mice.
[18] A. Small, S. Cole, J. J. Wang, S. Nagpal, Ling-Yang Hao, M. Wechalekar.(2022). Attenuation of the BTLA/HVEM Regulatory Network in the Circulation in Primary Sjögren’s Syndrome.
[19] Zhigang Rong, Fei Zhang, Zhengdong Wang, Weifeng He, S. Dong, Jianzhong Xu, F. Dai.(2018). Improved Osteogenesis by HVEM-Expressing Allogenic Bone Marrow-Derived Mesenchymal Stem Cells in an Immune Activation Condition and Mouse Femoral Defect Model.
[20] Yanbo Kou, Xingping Zheng, Liyuan Meng, Mengnan Liu, Shihong Xu, Qiyue Jing, Shenghan Zhang, Hanying Wang, Jinzhi Han, Zhuanzhuan Liu, Yanxia Wei, Yugang Wang.(2022). The HVEM-BTLA Immune Checkpoint Restrains Murine Chronic Cholestatic Liver Injury by Regulating the Gut Microbiota.
[21] H. Douna, J. Amersfoort, F. Schaftenaar, M. Kröner, Máté G Kiss, B. Slütter, M. Depuydt, Mireia N A Bernabé Kleijn, A. Wezel, H. Smeets, H. Yagita, C. Binder, I. Bot, G. V. van Puijvelde, J. Kuiper, A. Foks.(2019). BTLA stimulation protects against atherosclerosis by regulating follicular B cells.



