武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
IF=52.7|客户文献:靶向SKAP2可通过调节线粒体组织和细胞骨架重塑来恢复精子活力和形态
19 人阅读发布时间:2026-01-09 13:40
文献名称:Targeting SKAP2 restores sperm motility and morphology through modulating mitochondrial organization and cytoskeletal remodeling
发表期刊:Signal Transduct Target Ther
影响因子:52.7
客户单位:浙江大学、复旦大学
男性不育已成为全球性健康问题,其中弱畸精子症(asthenoteratozoospermia)是常见原因之一。尽管部分病例与遗传突变相关,但其分子机制尚不明确,且缺乏针对性治疗策略。2025年12月24日,浙江大学、复旦大学研究团队在"Signal Transduction and Targeted Therapy"期刊上发表了一篇题为" Targeting SKAP2 restores sperm motility and morphology through modulating mitochondrial organization and cytoskeletal remodeling "的研究论文。通过系统筛选与功能验证,首次揭示了hnRNPR基因及其下游靶点SKAP2在精子形成过程中的核心调控作用,并创新性地提出基于细胞外囊泡(mEVs)的蛋白递送策略,为男性不育的治疗提供了新思路。
1.首次揭示HNRNPR-hnRNPR-SKAP2轴在精子发生中的关键作用,阐明m6A依赖性剪接的新机制。
2.突破性治疗策略:利用天然细胞外囊泡递送SKAP2蛋白,实现非侵入性修复遗传缺陷导致的精子功能异常。
3.临床转化潜力:在人类精子中验证mEVs-SKAP2的治疗效果,为弱畸形精子症提供精准干预靶点。
研究团队招募了572名弱畸形精子症患者,对其中两个家系(一个近亲结婚家庭和一个非近亲结婚家庭)的三名不育男性进行了全外显子测序(WES)。结果在近亲结婚家庭的兄弟二人中发现了HNRNPR 基因的纯合错义突变(c.1540 G > A)(图1b, c)。在非近亲结婚家庭的先证者中发现了该基因的复合杂合错义突变(c.1280 A > C, c.1369 G > A)(图1d, e)。Sanger测序证实了这些突变在家系内与疾病表型共分离(即患者携带突变,父母为杂合携带者,健康亲属不携带)。突变位点的蛋白结构域定位(图1f)鉴定出的突变均位于或邻近hnRNPR蛋白的RGG结构域,该结构域对RNA结合功能至关重要。精子表型分析(图1g-j)结果CASA 显示,尽管精子浓度正常,但携带突变患者的精子前向运动能力和形态正常精子比例均显著下降,符合弱畸形精子症的临床诊断(图1g, h);形态学染色和TEM 揭示了精子存在广泛的形态学异常,包括顶体脱落和颈部结构紊乱等超微结构缺陷(图1i, j)。研究证明了 HNRNPR 基因的突变是导致弱畸形精子症和男性不育的一个新的遗传病因。
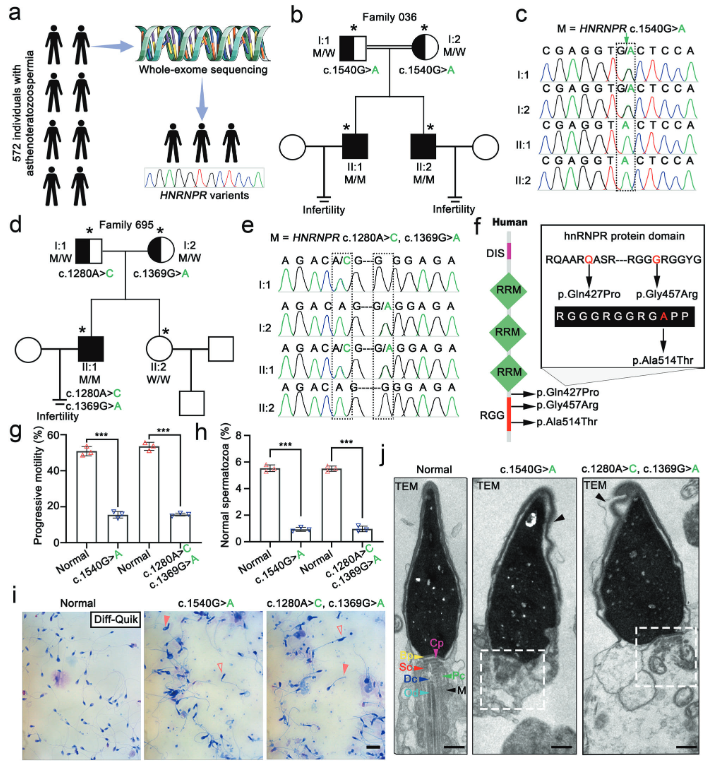
(图1:HNRNPR基因突变导致弱畸精子症和男性不育)
利用基因编辑技术,构建了携带Hnrnpr致病突变的基因敲入(Knock-in, KI)小鼠模型。结果发现,与野生型(WT)小鼠相比,KI小鼠的体型和睾丸与体重的比值均无显著差异(图2b及附图),表明突变不影响小鼠的整体生长和睾丸大小。生育力测试显示,Hnrnpr突变的雄性小鼠在与雌鼠合笼4个月后,完全未能产下任何后代,表现为完全不育(图2b)。PAS染色结果显示,KI小鼠的生精小管结构和总精子数量与WT小鼠相比没有明显差异(图2c-f),这表明Hnrnpr突变不影响精子的生成数量。CASA分析结果显示,尽管精子数量正常,但KI小鼠精子的总活力和前向运动能力均显著低于WT小鼠(图2g, h),复现了人类弱畸精子症的核心特征。结果证明,Hnrnpr突变在小鼠模型中同样导致雄性不育。这种不育并非源于精子生成障碍或数量减少,而是由于精子运动功能的严重缺陷,从而成功在体内再现了HNRNPR突变在人类中引起的病理表型。
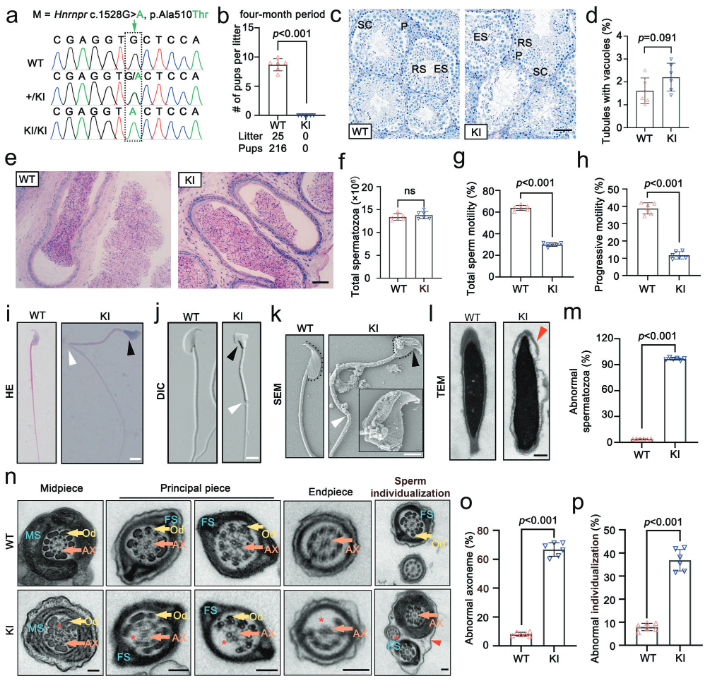
(图2:HNRNPR基因突变导致弱畸精子症和男性不育)
对野生型(WT)和突变(KI)小鼠的睾丸切片进行PAS和PNA染色,首次在精子细胞发育的第9步观察到了明显的顶体缺陷(图3a),表明Hnrnpr突变在精子形成的早期阶段就造成了影响。利用透射电子显微镜(TEM),对不同发育阶段的精子细胞进行高分辨率成像,结果发现WT小鼠的顶体正常形成、迁移,细胞核正常伸长,KI小鼠表现出明显的顶体畸形,并且发育中的顶体位置错误(异位),未能正确附着在细胞核表面(图3b)。通过TEM观察精子头帽(一种对塑造精子头部和鞭毛至关重要的临时微管结构),并利用α-微管蛋白免疫染色进行定位和长度定量分析。结果发现,与WT小鼠相比,KI小鼠的精子头帽定位异常、过度伸长且结构不对称,其微管长度显著长于对照组(图3c-e)。细胞水平和超微结构水平证明,hnRNPR蛋白对于精子发生过程中的顶体正确附着、精子头帽的正常组织以及细胞核的顺利伸长至关重要。Hnrnpr突变通过破坏这些关键的形态建成步骤,最终导致了精子畸形。
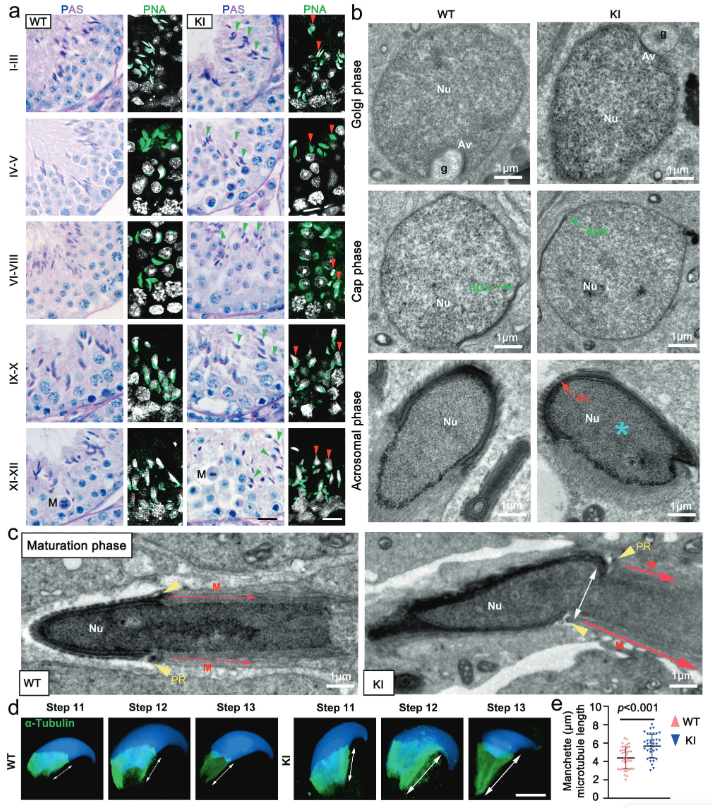
(图3:基因敲入小鼠精子中顶体、细胞核和尾袖组装的异常)
转录组、蛋白质调控和RNA剪接的改变归因于Hnrnpr突变
对野生型(WT)和突变(KI)小鼠的圆形精子细胞进行单细胞RNA测序,在KI小鼠中鉴定出498个差异表达基因(DEG),其中261个下调,237个上调(图4a),基因本体(GO)分析显示,这些差异基因显著富集在与细胞骨架组织和精子运动相关的生物学通路中(图4b),在下调基因中,Skap2基因的表达水平在KI小鼠中显著降低(图4c),通过RT-qPCR实验,证实了Skap2 mRNA在突变小鼠圆形精子细胞中的表达量确实显著下降(图4d)。对人类和(KI/WT)小鼠的睾丸及成熟精子进行比较蛋白质组学分析,在不同物种和组织的样本中,共鉴定到63个共同的差异表达蛋白(图4e),这些重叠的蛋白质同样显著富集在精子细胞骨架组织和F-ACTIN组装等通路中(图4f),与转录组分析结果高度一致,通过整合转录组和蛋白质组数据,发现SKAP2是同时在RNA和蛋白质水平发生改变的关键分子(图4g),在差异蛋白中,高达71.08%的蛋白与精子细胞骨架相关,其中77.15%与顶体形成和功能有关(图4h)。热图进一步展示了多种细胞骨架和F-ACTIN相关蛋白的表达变化(图4i, j)。对分离的圆形精子细胞进行蛋白质印迹分析,结果与转录组和蛋白质组学数据一致,SKAP2蛋白和F-ACTIN蛋白的水平在KI小鼠中均显著降低(图4k, l)。多组学联合分析的结果强有力地证明了Hnrnpr突变在转录和翻译两个层面均导致SKAP2和F-ACTIN表达下调。这些分子层面的变化直接解释了精子细胞骨架重塑缺陷,是导致精子形态异常和运动能力下降的关键分子机制。
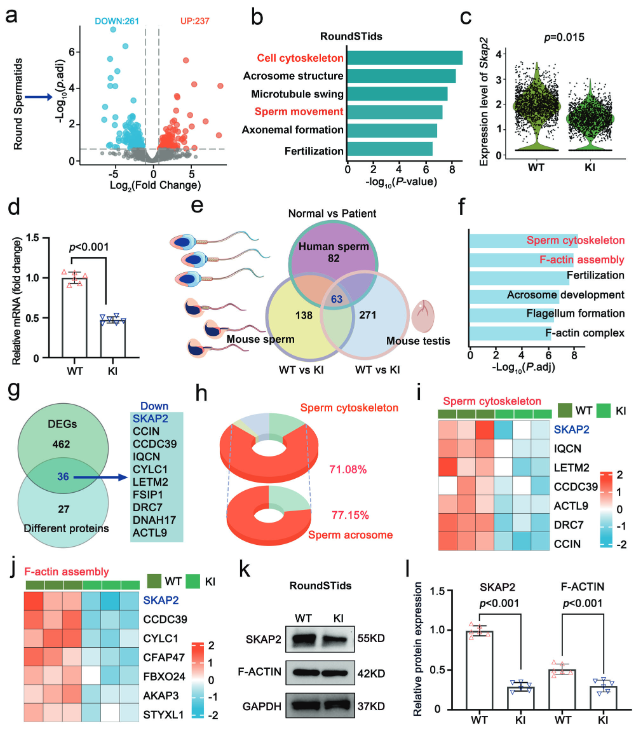
(图4:基因敲入小鼠中异常的RNA和蛋白质特征谱)
hnRNPR通过m6A依赖性方式调节Skap2的可变剪接
通过RNA免疫沉淀测序(RIP-seq),鉴定hnRNPR蛋白在圆形精子细胞中直接结合的RNA靶标。发现hnRNPR蛋白结合的RNA区域,其序列特征和分布位置都与已知的m6A修饰位点高度重合(图5a-e)。这表明hnRNPR可能作为一种m6A“阅读器”来发挥作用。整合RIP-seq、m6A测序和差异剪接分析三组数据,发现Skap2是同时满足“被hnRNPR结合”、“被m6A修饰”和“在突变小鼠中发生异常剪接”这三个条件的关键基因(图5f)。进一步分析显示,突变小鼠的Skap2基因发生了外显子2的跳跃,即剪接错误。构建了包含Skap2基因片段的小基因报告系统,并特异性地破坏了其上的m6A修饰位点,然后在细胞中观察剪接变化。结果发现,破坏m6A位点后,Skap2基因的外显子2同样发生了跳跃,成功在体外重现了突变小鼠的剪接缺陷(图5g-k)。一系列证据链证明,hnRNPR通过识别Skap2 mRNA上的m6A修饰位点,来确保其被正确剪接。而Hnrnpr突变破坏了这一精确的调控过程,导致Skap2剪接异常,是其下游致病的关键环节。
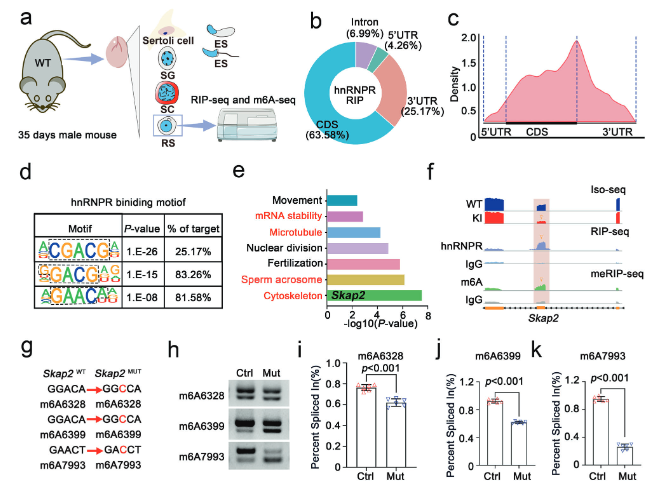
(图5:hnRNPR蛋白通过m6A介导调控Skap2转录本的可变剪接)
SKAP2通过调节精子细胞骨架组织来维持精子发生和男性生育能力
由于全身性敲除Skap2会导致小鼠胚胎期死亡,研究人员构建了在雄性生殖细胞中特异性敲除Skap2的条件性基因敲除小鼠模型。通过RT-qPCR、蛋白质印迹和免疫荧光(IF)实验,成功证实了SKAP2蛋白在突变小鼠的生殖细胞中被有效敲除(图6b-e)。将基因敲除(Skap2 D-cKO)雄性小鼠与野生型雌鼠合笼,进行生育力测试,结果显示Skap2 D-cKO雄性小鼠表现为完全不育,证实了SKAP2对雄性生育力至关重要(图6n)。使用透射电子显微镜(TEM)进行精子形态学分析。观察到大部分精子的尾部鞭毛缺乏关键的“9+2”轴丝微管结构,这是导致其无法正常运动的根本结构缺陷(图6f-i)。此外,图6l, m还显示对精子头部塑形至关重要的精子头袖结构也发育异常。采用计算机辅助精子分析(CASA)技术定量检测精子的运动参数。发现与野生型小鼠相比,Skap2 D-cKO小鼠精子的总活力和前向运动能力均显著下降,表现出典型的弱精子症特征(图6j, k)。上述结果证明,在雄性生殖细胞中特异性敲除Skap2基因,足以完美复现由Hnrnpr突变导致的所有关键表型(包括精子尾部结构缺失、活力低下和雄性不育)。这最终确认了SKAP2是hnRNPR-SKAP2信号轴中直接导致精子异常的核心执行者。
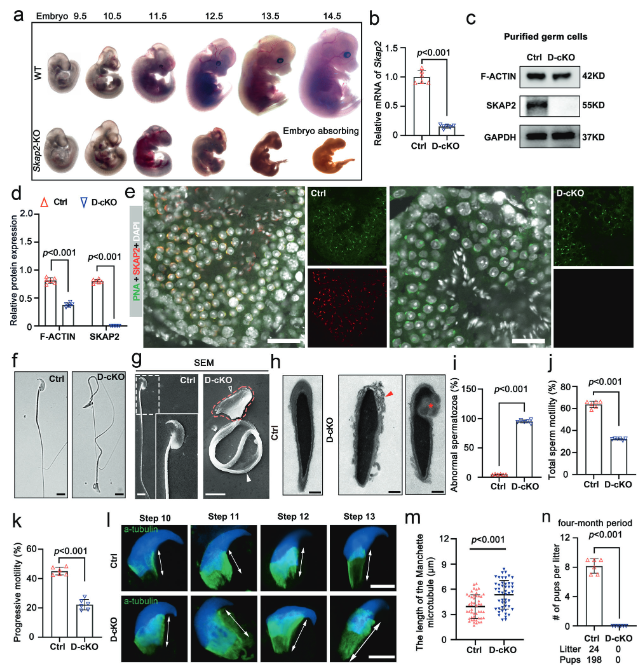
(图6:SKAP2 缺陷干扰精子发生并导致畸形精子)
将装载SKAP2蛋白的细胞外囊泡(mEVs-SKAP2),通过显微注射方式注入Hnrnpr突变(KI)小鼠的睾丸输出小管中,然后使用计算机辅助精子分析(CASA)评估治疗效果。结果发现,与未治疗组或仅注射空囊泡的对照组相比,接受mEVs-SKAP2治疗的小鼠,其精子总活力和前向运动能力均显著提升,同时形态异常的精子比例也显著降低(图7a-d)。利用透射电子显微镜(TEM)观察治疗后精子的超微结构变化,结果显示,mEVs-SKAP2治疗显著减少了精子尾部弯曲和顶体脱落等形态缺陷,但精子尾部轴丝的“9+2”核心微管结构并未得到修复(图7f-j),表明该疗法主要改善次级结构缺陷。通过免疫荧光染色,检测并量化精子细胞中关键细胞骨架蛋白F-ACTIN的组装情况,发现mEVs-SKAP2治疗能够显著恢复F-ACTIN的正常组装和定位(图7k)。这从分子层面解释了精子形态和运动能力得到改善的原因,即SKAP2通过修复细胞骨架来发挥作用。结果证明,mEVs-SKAP2是一种有效的体内治疗策略。它可以通过修复细胞骨架结构(F-ACTIN)来显著改善精子活力和部分形态缺陷,为治疗由特定基因突变引起的男性不育提供了新的潜在方案。
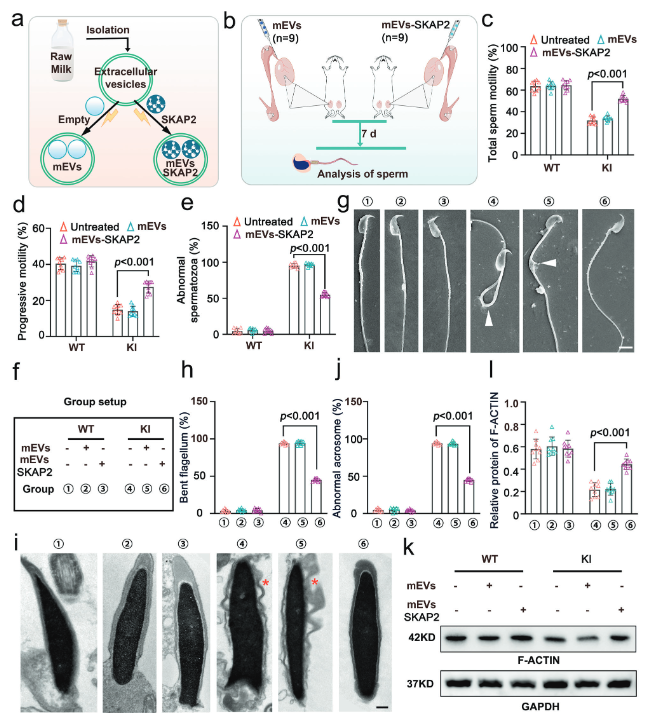
(图7:细胞外囊泡-SKAP2恢复Hnrnp r突变小鼠的精子运动能力和形态)
采用冷冻断裂法结合扫描电子显微镜技术,对小鼠精子尾部中段的线粒体进行高分辨率的超微结构观察。在未经治疗的Hnrnpr突变(KI)小鼠中,精子尾部的线粒体鞘结构紊乱且排列松散,无法形成正常的致密结构。经mEVs-SKAP2治疗后,精子的线粒体结构得到了显著改善(图8a-d)。本研究从线粒体层面揭示了mEVs-SKAP2的治疗机制。该疗法能够有效修复精子线粒体鞘的组织结构,使其排列更紧密有序。这种结构优化有助于提高ATP的生产和供应效率,从而为精子运动能力的恢复提供了坚实的能量基础。
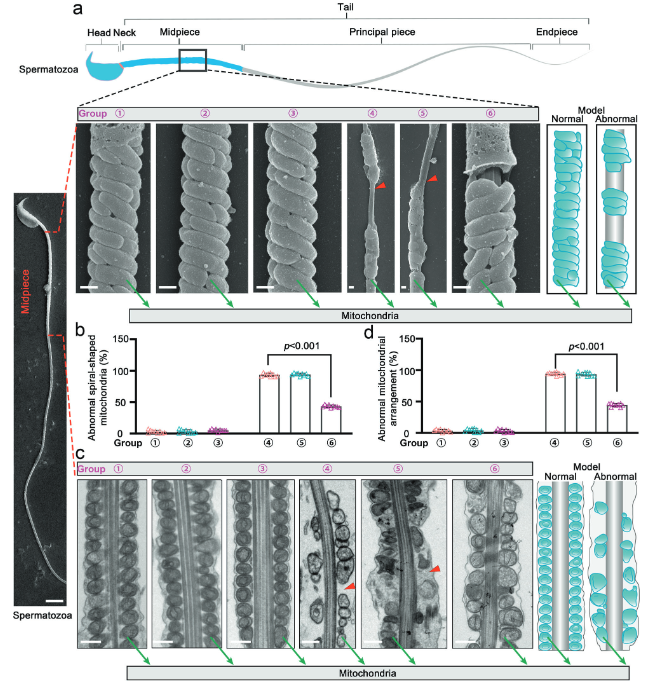
(图8:mEVs-SKAP2恢复小鼠精子中线粒体结构)
将装载SKAP2的细胞外囊泡(mEVs-SKAP2)与不同来源的人类精子(健康人群、HNRNPR突变患者及其他弱畸形精子症患者)共同培养,然后使用计算机辅助精子分析(CASA)进行检测。结果显示,与未治疗组相比,mEVs-SKAP2处理显著增强了所有组别人类精子的总活力和前向运动能力,表明该疗法在体外同样有效(图9b, c, e)。对上述处理后的人类精子进行形态学分析,发现mEVs-SKAP2对精子整体的形态改善效果有限,但显著减少了精子尾部弯曲的比例(图9d, e)。利用透射电子显微镜(TEM)观察体外治疗后的人类精子尾部结构,其结果与体内治疗结果一致,虽然mEVs-SKAP2处理部分缓解了精子尾部弯曲,但其核心的“9+2”轴丝微管结构并未得到修复(图9e)。同样的结果也体现在小鼠模型的体外实验中。通过免疫荧光染色技术,检测体外处理后的人类和小鼠精子中关键细胞骨架蛋白F-ACTIN的聚合情况,发现mEVs-SKAP2处理能够显著促进F-ACTIN蛋白的聚合,这为体外精子运动能力的恢复提供了直接的分子机制证据(图9f, g)。研究结果表明,mEVs-SKAP2疗法在体外对人类和小鼠精子均有效。它通过重塑细胞骨架(促进F-ACTIN聚合)来显著提升精子运动能力并改善部分形态缺陷(如尾部弯曲),但无法修复精子尾部的轴丝核心结构。这证明了该疗法在临床辅助生殖技术中具有广阔的应用前景。
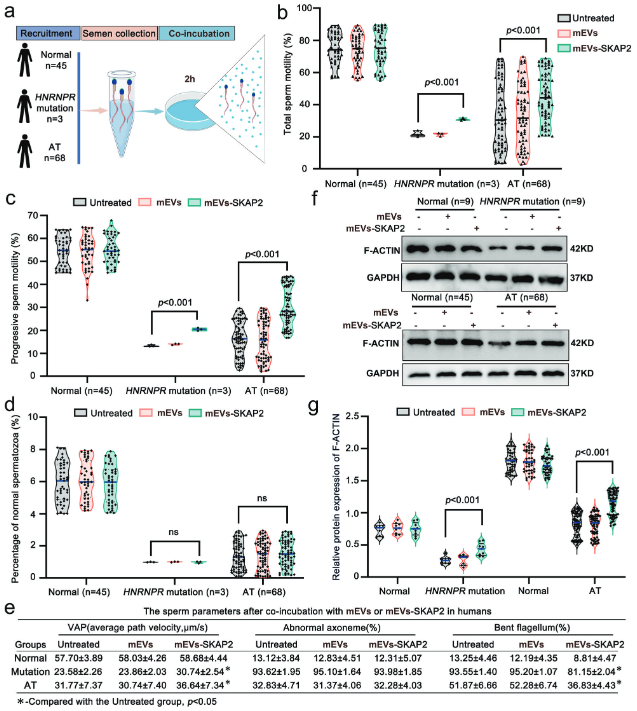
(图9:mEVs-SKAP2缓解人类精子中的弱畸形精子症)
本研究揭示了由HNRNPR介导的m6A-依赖性RNA剪接调控SKAP2是导致弱畸精子症的关键致病机制,并据此开发出基于细胞外囊泡的SKAP2蛋白递送疗法,为男性不育症提供了从分子机理到靶向治疗的全新策略。
CUSABIO助力产品
在本研究中,研究人员用到了CUSABIO的TUBA1A单克隆抗体(货号:CSB-MA754656A0m),在免疫荧光实验中检测微管蛋白α-Tubulin的表达。

CUSABIO致力于为全球科研工作者提供让您满意的生物试剂,助力生命科学研究的创新与转化。
参考文献:Targeting SKAP2 restores sperm motility and morphology through modulating mitochondrial organization and cytoskeletal remodeling. Signal Transduct Target Ther, 2025 Dec 24.



