武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
Western Blot避坑指南:高频问题解析与科学解决方案
505 人阅读发布时间:2025-08-01 10:33
Western Blotting (WB),作为分子生物学实验室的“常青树”技术,是揭示蛋白质表达奥秘的关键工具。然而,从样品制备到数据呈现的漫长征程中,无数科研人曾深陷条带消失、背景污浊、结果不可重复的泥潭。本文将基于核心实验流程,系统梳理WB实验中的高频“雷区”并提供切实可行的避坑方案,助您获得清晰、可靠、可发表的数据。
平衡设计是关键:技术偏差无处不在。上样时,避免将同一组样品集中在凝胶的特定区域(如边缘或中心),应采用随机化或平衡位置设计,防止因凝胶电泳不均或转印效率差异导致的假阳性/阴性结果。
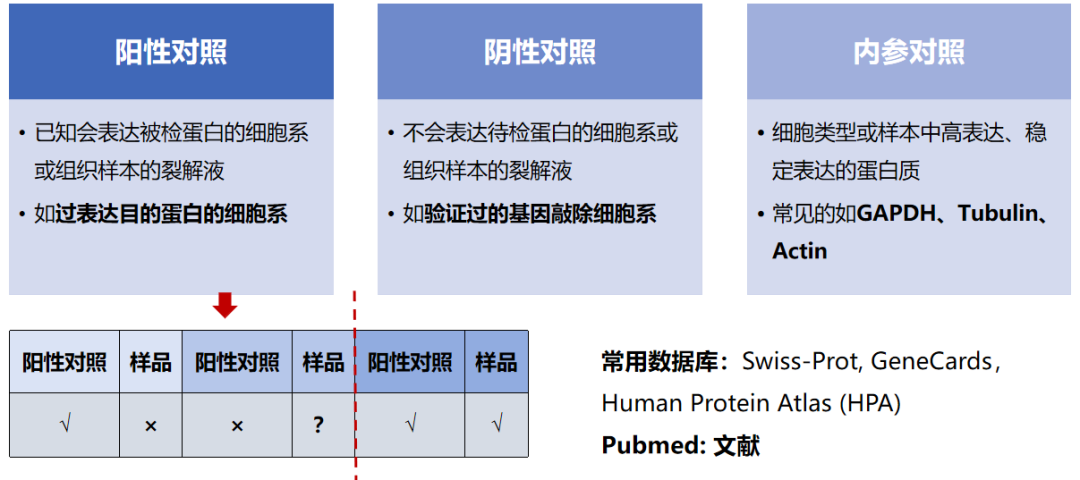
对照设置不可少:
阳性对照(Positive Control): 明确已知表达目标蛋白的样本,验证实验体系(抗体、试剂)有效性的“定心丸”。
阴性对照(Negative Control): 如已知不表达目标蛋白的样本或空白载体细胞,排除非特异性结合干扰。
内参对照(Loading Control): 如β-Actin, GAPDH, Tubulin等,校正上样量与转印效率,是准确定量的基石。核心要求:内参蛋白必须与目标蛋白在同一块膜上检测,避免跑平行胶! (Tie et al., 2021)。
空白对照(Blank Lane): 仅含缓冲液的泳道,帮助识别背景污染来源。
裂解缓冲液的选择直接决定目标蛋白能否被有效释放并保持其状态。此环节常见问题源于对目标蛋白特性了解不足:
关键三问:
定位在哪?可溶性胞质蛋白?不溶性蛋白(如包涵体、核基质)?膜结合蛋白?这决定了是否需要强效去垢剂(如SDS、Triton X-100)或特殊处理(如超声)。
状态如何?是否需要保护翻译后修饰(如磷酸化)?这要求添加相应酶抑制剂(磷酸酶抑制剂、蛋白酶抑制剂混合物)。
如何定量?常用BCA或Bradford法。警惕! 裂解液中的某些成分(如高浓度去垢剂、还原剂)可能干扰定量结果,需选择兼容方法或进行稀释优化。
解决方案:充分查阅文献(PubMed, GeneCards, Human Protein Atlas)了解目标蛋白特性,严格根据定位和实验需求(如是否需保持活性/修饰)选择并优化裂解缓冲液配方,确保定量准确可靠。
蛋白质在电场中根据分子量(MW)、形状和电荷实现分离。凝胶浓度(即孔径大小)是决定分离效果的核心因素。
常见误区:盲目使用单一浓度凝胶分离分子量范围差异巨大的蛋白,导致小分子量蛋白“跑穿”或大分子量蛋白“卡住”。
解决方案:根据目标蛋白的预期分子量选择最佳分离胶浓度:
高浓度胶(如12-15%):适合小分子量蛋白 (<50 kDa),孔径小,分离效果好。
低浓度胶(如7.5-10%):适合大分子量蛋白 (>50 kDa),孔径大,利于大分子迁移。
梯度胶:可同时有效分离宽范围分子量的蛋白混合物。务必参考Marker的指示范围。
抗体的特异性与亲和力是WB成功的核心。问题常源于抗体选择不当或使用错误。
高频问题:
01.无条带/信号弱:

原因:抗体失效(过期、反复冻融、储存不当);一抗/二抗浓度过低;孵育时间/温度不足;目标蛋白丰度极低;转印效率差(膜选择不当、转印条件不佳);封闭过度。
解决方案:验证抗体有效性(阳性对照);优化抗体浓度及孵育条件(时间、温度);尝试更灵敏的检测系统(如ECL增强型);优化转印参数(确认转印效率,如丽春红染色);尝试不同封闭剂或调整封闭时间;富集目标蛋白(如IP)。
02.背景过高:
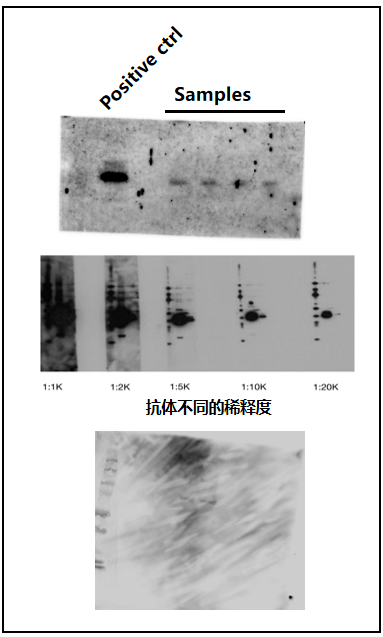
原因:一抗/二抗浓度过高;非特异性结合(封闭不充分、膜未清洗干净、抗体交叉反应);膜干燥;曝光过度。
解决方案:降低一抗/二抗浓度;优化封闭条件(延长封闭时间、更换封闭剂如BSA或脱脂奶粉);增加洗膜次数、时间及强度(可尝试高盐TBST);保持膜湿润;缩短曝光时间或降低ECL试剂浓度。
03.异常条带:
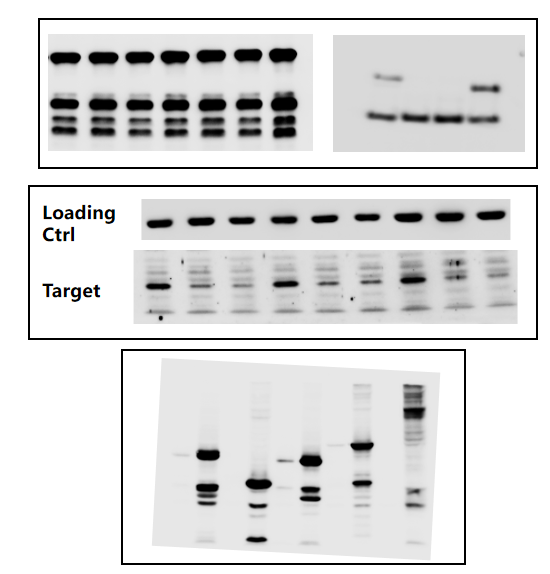
非特异性条带:抗体特异性差(识别其他蛋白);蛋白降解(样品处理不当);二聚体/多聚体形成。
条带位置不符:翻译后修饰(如糖基化、磷酸化改变表位或迁移率);蛋白剪切;同源蛋白交叉反应;分子量Marker不准。
解决方案:选择特异性高、验证数据充分的抗体(重组抗体、单抗特异性通常更好);确保样品新鲜并添加足量蛋白酶抑制剂;查阅文献确认目标蛋白可能的修饰形式及迁移率;验证Marker准确性;尝试不同厂家/批次的抗体。
04.条带不均匀/拖尾/微笑条带:
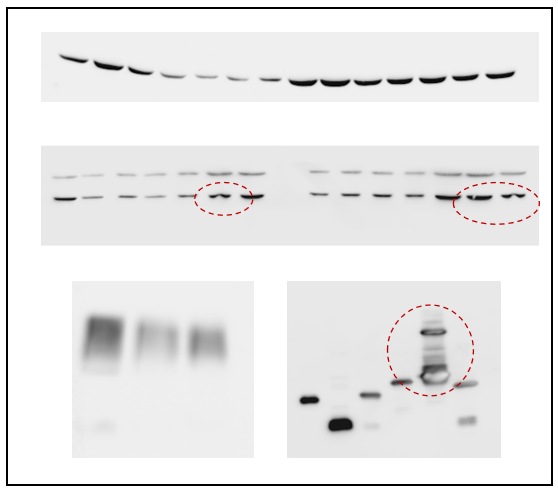
原因:上样量差异大;样品未充分混匀或含不溶物;电泳时电流/电压不稳定或温度过高(需冰浴);凝胶聚合不均或有气泡;电极缓冲液离子强度不均或重复使用次数过多。
解决方案:精确测定蛋白浓度并保证等量上样;充分离心去除不溶物,上样前混匀样品;确保电泳装置连接良好,使用恒压/恒流模式,并在冷室或冰浴中进行;灌胶操作规范,避免气泡;及时更换新鲜电极缓冲液。
期刊对WB数据的规范性和可追溯性要求日益严格(Kroon et al., 2022)。不规范的数据呈现是拒稿的常见原因。
核心要求:
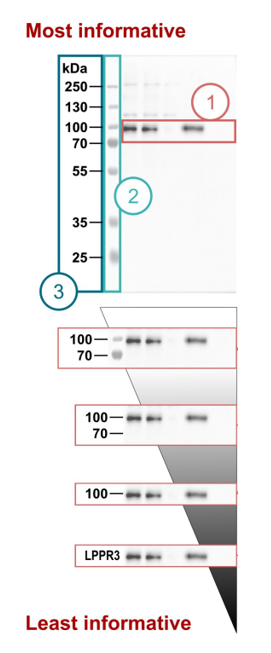
提供完整原始图像:
必须是未裁剪、未调整的整个印迹膜或凝胶的扫描图。
若膜被切割,必须保留目标蛋白泳道上方和下方至少一个明确的标记蛋白泳道(如Marker、关键内参或阳性对照),以精确定位。
严禁仅提供裁剪过的单一目标条带图!
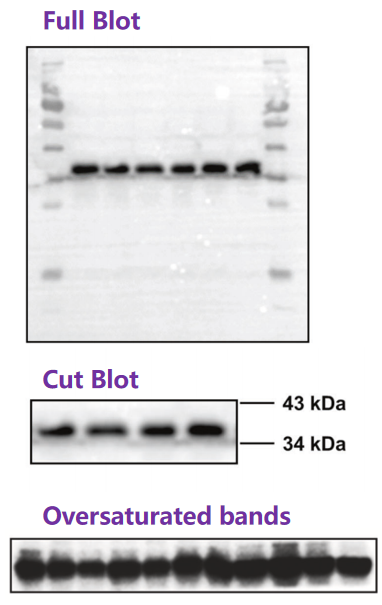
原始图像处理规范:
提交的原始扫描图应尽可能保持“原始状态”。
允许对整个图像进行轻微、线性的亮度/对比度调整,以改善肉眼可读性。必须声明是否进行过任何调整。
绝对禁止:选择性调整局部区域(如只调目标条带)、非线性调整(如伽马值调整)、过度调整导致背景消失或条带过饱和、涂抹或擦除条带等任何改变数据真实性的操作。过饱和条带是硬伤!
详尽标注信息:
泳道注释:清晰标注每个泳道对应的样本、处理条件、对照类型。
分子量Marker: 必须完整显示且条带清晰可辨,标注关键分子量位置。
抗体信息:必须提供所用所有抗体的详细信息清单,包括:抗体名称(商品名及克隆号)、宿主物种、类型(单抗/多抗)、生产商、货号、使用的稀释比例。重组抗体、标签抗体需特别说明。
内参与定量:明确标注用于归一化的内参蛋白,并说明定量分析方法。
重复性:展示具有统计学意义的独立重复实验结果(通常n≥3),不能仅凭单次实验下结论。
发表必备自查清单(务必逐项核对!):
是否保存并备份了未裁剪、未调整的原始WB扫描图?
内参蛋白和目的蛋白是否来源于同一张膜?如果进行了跨膜比较,是否在图中清晰标注?
展示的图像是否避免了过度调整对比度/亮度?是否有过饱和条带?
分子量Marker是否完整可见,关键条带位置是否标注?
所有泳道是否清晰标注了对应的样本和条件?
是否提供了完整的抗体信息列表(名称、克隆号、来源、稀释比例)?
是否说明了定量方法和使用的内参?
图中展示的结果是否包含独立生物学重复?统计分析是否恰当?
引用的抗体是否有可靠的验证数据支持其在该应用中的特异性?
当遇到目标蛋白表达量极低、难表达蛋白(如膜蛋白)、需要高特异性抗体或自身实验条件受限时,寻求专业CRO服务是高效选择:
一站式解决方案:如华美生物等机构提供从基因合成、蛋白表达(尤其复杂蛋白)、抗体制备(多抗、单抗、重组抗体)、到抗体筛选(针对膜蛋白/非膜蛋白先导分子)的全流程服务,可极大缩短研发周期,解决基础科研中的棘手难题。
专业平台优势:其积累的丰富经验和技术平台(如杂交瘤、重组抗体技术),往往能提供比常规商业抗体更优的特异性和亲和力解决方案。
结语
Western Blot的成功绝非偶然,它是严谨实验设计、规范操作细节与科学问题解决能力的综合体现。从最初的实验规划到最终的数据呈现,每个环节都可能隐藏着影响结果的“坑”。深入理解原理,严格遵守规范,系统排查问题,并善用工具与资源,方能有效规避陷阱,让清晰的条带诉说真实的生物学故事,为高质量科研产出铺平道路。牢记:规范、透明、可重复是WB数据通向发表的通行证。
参考文献:
[1]Omondi, C., Chou, A., Fond, K.A. et al. Improving rigor and reproducibility in western blot experiments with the blotRig analysis. Sci Rep 14, 21644 (2024).
[2]Tie, L., Xiao, H., Wu, Dl. et al. A brief guide to good practices in pharmacological experiments: Western blotting. Acta Pharmacol Sin 42, 1015–1017 (2021).
[3]Kroon C, Breuer L, Jones L, An J, Akan A, et al. (2022) Blind spots on western blots: Assessment of common problems in western blot figures and methods reporting with recommendations to improve them. PLOS Biology 20(9): e3001783.



