武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
抑瘤素 M (OSM): 白介素 IL-6 细胞因子家族成员,肿瘤、骨代谢、慢性炎症性等疾病的潜力靶点?
890 人阅读发布时间:2023-11-24 17:35
细胞因子是由活化的免疫细胞产生的,包括促炎因子和抗炎因子,主要在免疫应答过程中起着重要的调节作用。许多与炎症相关的细胞因子被作为监测肿瘤或免疫性疾病风险的新靶点。白介素 IL-6 家族作为重要的促炎因子,在炎症反应中的作用日益凸显。近年来,随着 IL-6 家族被不断深入地研究,OSM 作为 IL-6 细胞因子家族成员之一,OSM 在肿瘤形成及免疫调节中的作用引起了越来越多的关注。大量的证据显示,OSM 或许可以成为未来诊断、靶向治疗肿瘤等疾病的潜力靶点分子!
1. 白介素 IL-6 家族
2. 什么是抑瘤素 M(OSM)
-
2.1 OSM 的结构
-
2.2 OSM 的表达和功能
3. 什么是 OSM 的受体?
4. OSM 结合受体调节 JAK/STAT3 和 MAPK 信号通路
5. OSM 在疾病中的作用
-
5.1 OSM 和肿瘤
-
5.2 OSM 和骨代谢相关疾病
-
5.3 OSM 和炎症性肠病
-
5.4 OSM 和心血管疾病
-
5.5 OSM 和其它疾病
6. OSM 的临床研究前景
1. 白介素 IL-6 家族
白介素-6(interleukin-6,IL-6)家族是一组细胞因子(点击查看「细胞因子:白介素」专题),可以由多种细胞产生,它们以自分泌、旁分泌和内分泌的形式在信号转导中起作用。IL-6 细胞因子家族包括 IL-6、IL-11、IL-27、白血病抑制因子(LIF)、肿瘤抑制素 M(OSM)、睫状神经营养因子(CNTF)、心肌营养因子 1(CT-1)和心肌营养蛋白样细胞因子(CLCF 1)等。每个 IL-6 家族成员都在维持代谢、炎症和免疫稳态等生理调控中扮演着重要角色。众多研究发现,IL-6 细胞因子家族成员在调控肿瘤的发生及发展过程中发挥着双向作用,即抗肿瘤和促肿瘤作用。近年来,IL-6 细胞因子家族已成为肿瘤免疫学领域中的研究热点 [1-2]。
2. 什么是抑瘤素 M(OSM)?
2.1 OSM 的结构
抑瘤素 M(Oncostatin-M,OSM)属于 IL-6 家族成员中的多效性细胞因子,在 1986 年首次从 U937 组织性淋巴瘤细胞中释放并分离出来,因其可抑制黑色素瘤细胞的增殖能力而得名。OSM 基因位于 22q12 染色体上,由 3 个外显子和 2 个内含子组成,位置邻近于 LIF。OSM 蛋白全长含有 239 至 263 个氨基酸,折叠成一个与其他 IL-6 家族相似的四螺旋束长链蛋白(图 1)[3]。人源 OSM 多肽含 252 个氨基酸残基,N-末端是由 25 个氨基酸残基构成的信号肽,C-末端由 32 个氨基酸残基构成。对于 OSM 的转录和表达,STAT5 应答元件有重要作用,IL-2、IL-3、EPO、GM-CSF 等多种细胞因子能激活 STAT5,从而使 OSM 高表达;前列腺素 E2/PG-E2 能上调 OSM 转录 [3-5]。
2.2 OSM 的表达与功能
OSM 主要由激活的单核细胞、巨噬细胞、T 淋巴细胞和树突状细胞分泌。OSM 在维持造血微环境中起重要作用,它可通过调节 G-CSF 和 SDF-1 来维持祖细胞的造血功能。此外,OSM 可调节中枢神经系统的发育、肝脏再生、诱导心肌细胞的去分化、调节内皮细胞产生其他细胞因子和生长因子,并刺激血管生成。目前的体外研究已证明,OSM 具有多种生物学活性,在造血、细胞生长分化、炎症反应、代谢调控、肿瘤形成及免疫调节等方面发挥广泛的作用 [3-6]。
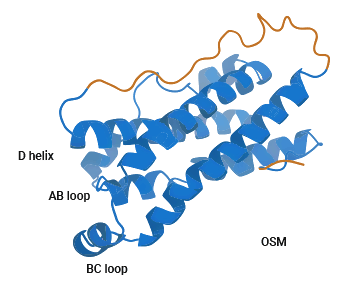
图 1. OSM 的结构 [3]
3. 什么是 OSM 的受体?
OSM 与 IL-6 超家族内的其他几种细胞因子共有一个 gp130 受体亚单位,但其与 gp130 低亲和力结合。也就是说,这些 IL-6 细胞因子的受体基本上都包含信号传导受体亚基 gp130 糖蛋白。虽然 gp130 在所有细胞中都有表达,但单独存在的 gp130 无法与细胞因子结合。单个 IL-6 细胞因子家族成员的受体是细胞特异性的,这就意味着不同的细胞类型,可以表达特定的 IL-6 细胞因子家族成员受体 [7-8]。
与其它 IL-6 家族细胞因子不同的是,OSM 可以通过两种不同的受体复合物发出信号,OSM 受体分为 I 型和Ⅱ型两种。I 型 OSM 受体(gp130/LIFRβ)是由一个 gp130 分子和一个 LIF 受体亚单位构成的异源二聚体,既可以与 LIF 结合,也可以与 gp130 结合而启动信号转导。Ⅱ型 OSM 受体(gp130/OSMRβ)是由一个 gp130 分子和一个 OSM 受体 β 亚单位构成的异源二聚体,Ⅱ型受体具有 OSM 特异性,不能结合 LIF 及家族中的其他细胞因子(图 2)[8]。
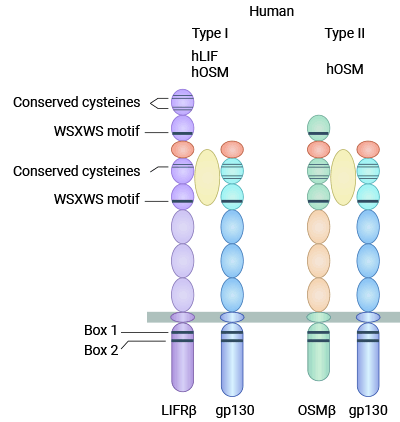
图 2. I 型 OSM 受体(gp130/LIFRβ)和 Ⅱ 型 OSM 受体(gp130/OSMRβ)[8]
4. OSM 结合受体调节 JAK/STAT3 和 MAPK 信号通路
SM 与不同的两种受体(gp130/LIFRβ;gp130/OSMRβ)结合后,会激活两个不同的信号通路:JAK/STAT3 通路和丝裂原活化蛋白激酶(MAPK)通路。这两条通路在细胞内扮演关键角色,参与调节细胞的多种生物学响应(图 3)[9]。
具体而言,JAK/STAT3 通路通过与 gp130/OSM 受体 β 亚单位复合体结合来启动。这一过程导致受体复合体二聚体化和相互磷酸化,激活 Janus 激酶(JAK)。JAK 激酶活化导致 gp130 胞浆区的酪氨酸残基磷酸化。然后,信号转导因子和转录激活分子(STAT)识别这些磷酸化的受体,促使 STAT 分子自身被磷酸化。这种磷酸化状态导致 STAT 形成同源和异源二聚体,并进入细胞核作为活性转录因子,对特定基因的表达产生影响 [9]。
另一方面,gp130 酪氨酸残基磷酸化吸引酪氨酸磷酸酶,并为生长因子受体结合蛋白2(Grb2)提供一个连接点。这样一来,Grb2 可以连接到 SOS 蛋白(son of sevenless),激活 SOS。SOS 可以促使原癌基因 c-ras 的产物 Ras 蛋白从 GDP 释放出来,与 GTP 结合,进而激活 Ras。激活的 Ras 可以影响下游的 Raf-1 并激活它。Raf-1 激活 MAPK,并使其磷酸化并转变为活性状态。接着,激活的 MAPK 作用于细胞外信号调节蛋白激酶(ERK)1/2,使其活化。活化的 ERK1/2 进入细胞核,作用于特定的转录因子,影响基因的表达,因此发挥生物学活性 [9]。
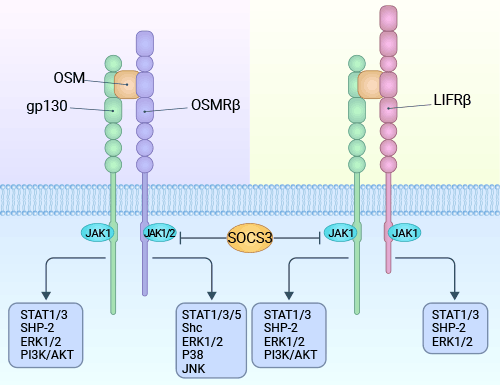
图 3. OSM 通过两种类型的受体传导信号:I 型受体(gp130/LIFRb)和 II 型受体(gp130/OSMRb)复合物 [9]
5. OSM 在疾病中的作用
OSM 作为一种多功能的细胞因子,研究者对于 OSM 的功能及其作用机制还存在许多未知之处。OSM 最初是在黑色素瘤中被发现可以抑制肿瘤细胞生长。随后的研究逐渐揭示,OSM 在器官发育、组织损伤与再生等方面也起到重要的调控作用。然而,在不同的环境下,OSM 对细胞增殖或分化可能起着不同甚至完全相反的作用。目前,对于 OSM 在疾病中的研究主要集中在肿瘤、骨代谢、造血以及慢性炎症性疾病方面。
5.1 OSM 和肿瘤
OSM 细胞因子在肿瘤中的作用并不是单一的。据报道,OSM 所引起的这两种完全相反的效应与癌症的发展阶段或恶性程度之间存在一定的关联。总的来说,在正常上皮细胞和一些早期肿瘤中,OSM 发挥着抑制增殖、抑制癌症进展的作用;然而,在恶性程度较高或具有转移倾向的肿瘤中,OSM 的高表达则与不良预后相关。
以肝癌细胞为例,OSM 通过激活 STAT3 信号途径、上调癌基因 c-Myc 表达的同时,也加速了细胞的衰老,从而最终表现为对肝癌细胞增殖的抑制作用(图 4)[9]。然而,在晚期肿瘤中,OSM 通常更多地表现为促进细胞增殖。具体地说,癌基因的激活所引发的细胞老化能够限制异常细胞的增殖,同时保持组织的健康状态,这是机体的一种防御机制。然而,癌基因诱发的细胞老化需要特定蛋白(如 p53 或 Rb)的参与,而这些蛋白在晚期癌细胞中通常受到损害。因此,这可能解释了为何 OSM 在不同情况下会对肝癌增殖产生抑制或促进的不同效应 [9-10]。
此外,OSM 还与其它多种肿瘤相关,包括黑色素瘤、肺癌细胞、乳腺癌、卵巢癌、胃癌等 [9-13]。例如,在乳腺癌中,OSM 可以通过下调细胞膜 E-cadherin 表达、上调 slug 和 snail 表达而诱导癌细胞的间叶细胞表型 [14];在胶质瘤中,OSM 所调控的间叶细胞表型可以增加胶质瘤细胞的迁移和侵袭能力,并且 OSM 表达水平同胶质瘤的恶性程度和患者的低生存率明显相关 [15];OSM 在 TGFβ 信号通路的协同作用下促进胃肠胰神经内分泌肿瘤(GEP-NENs)细胞的迁移与侵袭 [16]。
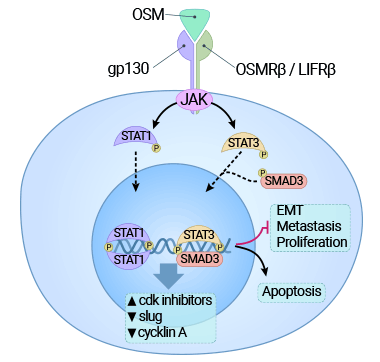
图 4. OSM 受体的结合激活 JAK3/STAT1 途径,并对癌细胞施加细胞毒作用 [9]
5.2 OSM 和骨代谢相关疾病
已有研究证实,LIF 和 OSM 均可调节大鼠颅骨细胞成骨细胞的分化过程。在体外实验中,小鼠成骨母细胞与骨形态发生蛋白 BMP-2 结合后,碱性磷酸酶增加,这提示在骨膜骨形成过程中,OSM 能诱导募集 BMP 或其他因子。另有报道,当用小鼠 OSM 或人类 OSM 刺激时,小鼠颅骨外植体释放胶原蛋白,并调节骨保护素(Osteoprotegerin,OPG)的表达,从而抑制骨吸收活性。在类风湿关节炎患者的关节,由滑膜细胞产生的 OSM 能间接降解蛋白质,引发炎性介质 PGE2 产生,促进基质降解 [17-18]。
采用 OSM/IL-1 或 OSM/TNF 刺激模型,发现 OSM 在软骨细胞和滑膜成纤维细胞中诱导 MMP-10,激活软骨细胞中的成纤维细胞活化蛋白-α,从而增强软骨代谢 [18]。此外,OSM 抗体可以调节关节炎小鼠体内 OSM 与 IL-1、TNF 等细胞因子的相互作用,显著减少胶原蛋白的分解,减轻炎症反应,该发现为关节炎的治疗提供了新思路 [19]。
5.3 OSM 和炎症性肠病
炎症性肠病 IBD 包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)。OSM 在炎性反应中发挥着促炎或抗炎作用。活动期 CD 患者结肠病变中 OSM 表达水平升高,但其也具有促进上皮修复的功能 [20]。另有报道,IBD 患者受损的肠道粘膜高表达 OSM 及其受体 OSMR。同时 OSM 还能诱导 IL-6、ICAM-1 等炎症因子的表达。对活动期 UC 患者分别予不同抗 TNF 药物治疗,结果发现抗 TNF-α 抗体 Infliximab 治疗无应答组粘膜 OSM 表达水平最高 [21-22]。因此,通过治疗性阻断 OSM,可减少 IBD 发病时肠粘膜表达的 OSM 等相关炎症因子。这也表明 OSM 或可作为潜在的治疗靶点。
5.4 OSM 和心血管疾病
陆续研究提示 OSM 可能参与心血管疾病的发生发展。OSM 可刺激内皮细胞产生 IL-6、G-CSF、GM-CSF 及粘附分子,促进中性粒细胞黏附 [23-24]。OSM 还通过调节 COX-2、血管生成素-2/ANG-2 促进微循环内皮细胞血管生成 [23-24]。此外,OSM 影响血管平滑肌细胞,如刺激细胞增殖和分泌 VEGF、IL-6 和 COX-2 [25]。在动脉粥样硬化中,OSM 通过影响内皮细胞、血管平滑肌细胞和血管生成发挥复杂作用 [26-27]。在心肌梗塞和心室重构中,OSM 的作用也复杂,可通过多种机制改善心脏功能,但在某些情况下可能产生不利影响 [26-27]。
5.5 OSM 和其它疾病
除此以外,OSM 还和多种代谢免疫以及神经性疾病相关 [28-29]。例如,OSM 可单独或与其他 GP130 细胞因子共同作用,影响脂肪组织的正常代谢,造成脂代谢紊乱,进而诱导糖尿病 [30];OSM 可通过 Ras/细胞外信号调节激酶(Ras/ERK)和 STAT5 信号通路调节 CCAAT 增强子结合蛋白 β(C/EBPβ)的表达来抑制脂肪细胞的分化,引起脂代谢紊乱 [31-32];OSMR 缺陷的小鼠表达 TRPV1/P2X3/OSMRβ 的神经元也大量减少,OSMR 缺陷的小鼠对机械刺激和热刺激等各种刺激的反应减退,提示 OSM 可作为神经保护性细胞因子,为探索 OSM 在 CNS 疾病中的治疗潜能提供了合理的基础 [33]。
6. OSM 的临床研究前景
OSM 是一种兼具多种生物活性的白介素 IL-6 家族细胞因子。众不同的是,OSM 在体外和体内通过 OSMRβ/gp130(II 型 OSM 受体)途径得到特异性激活,从而施展其独特作用。尽管关于其多样生物学活性的作用机制以及与其他细胞因子之间的相互作用尚存待解之谜,但正是这些未知领域为研究者们提供了进一步深入探索的机遇。尽管如此,根据当前的研究成果,可以肯定的是,OSM 激活剂以及其拮抗剂在临床疾病,如肿瘤、骨代谢、慢性炎症性等治疗领域有望呈现出广阔的应用前景。
为鼎力协助科研和药企人员针对 OSM 在多种免疫疾病和肿瘤中的临床应用研究,CUSABIO 推出 OSM 活性蛋白(CSB-MP017260 HU1),助力您在 OSM 机制方面的研究或其潜在临床价值的探索。
Oncostatin-M (OSM) 蛋白
● Recombinant Human OSM, partial (Active) (Code: CSB-MP017260 HU1)
High Purity Validated by SDS-PAGE
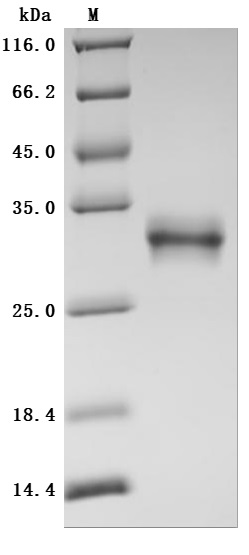
The high purity was greater than 95% as determined by SDS-PAGE.
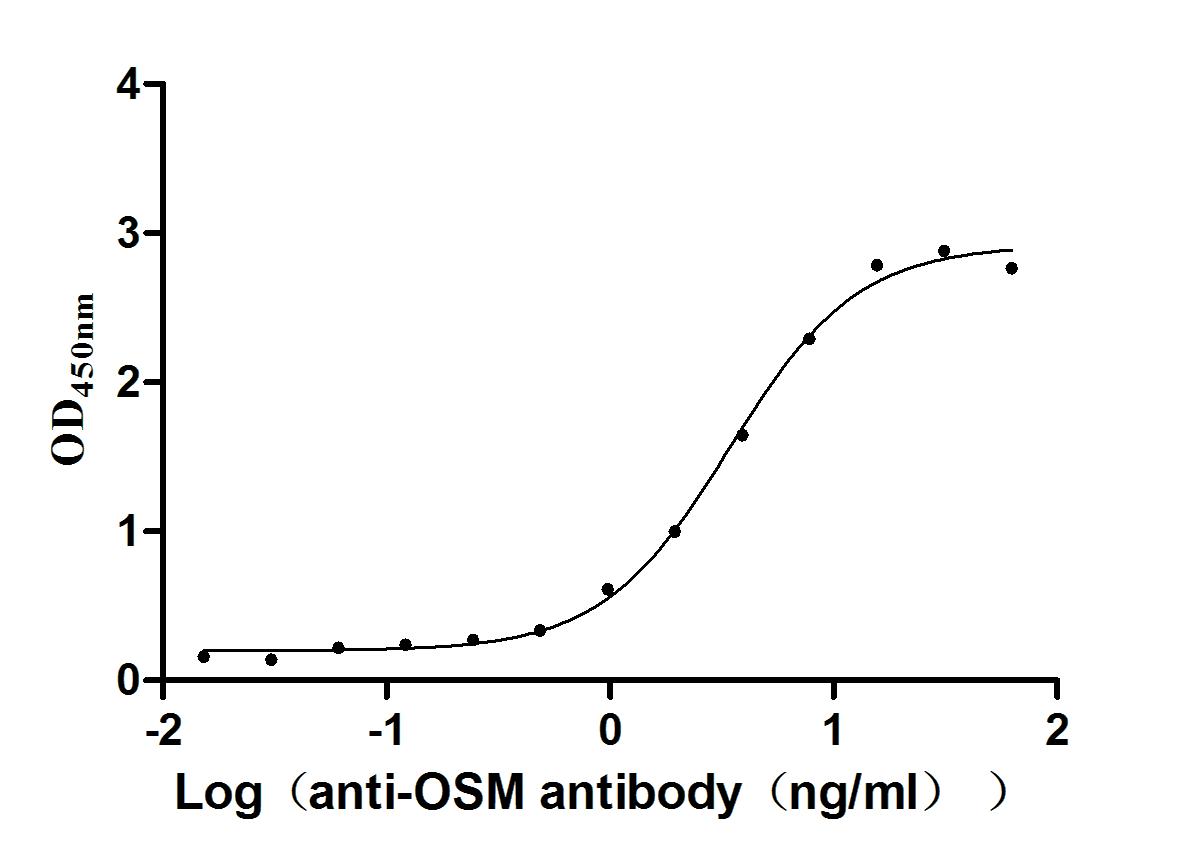
Immobilized Human OSM at 2 μg/mL can bind Anti-OSM recombinant antibody (CSB-RA017260MA1 HU). The EC50 is 3.048-3.860 ng/mL.
Oncostatin-M (OSM) 抗体
OSM Recombinant Monoclonal Antibody (Code: CSB-RA017260MA1 HU)
参考文献:
[1] Tanaka, Toshio, Masashi Narazaki, and Tadamitsu Kishimoto. "Interleukin (IL-6) immunotherapy." cold spring harbor perspectives in biology 10.8 ( 2018): a028456.
[2] Jones, Simon A., Jürgen Scheller, and Stefan Rose-John. "Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling." The Journal of clinical investigation 121.9 (2011): 3375-3383.
[3] Du, Qingqing, Yan Qian, and Weiwei Xue. "Molecular simulation of oncostatin M and receptor (OSM-OSMR) interaction as a potential therapeutic target for inflammatory bowel disease." Frontiers in Molecular Biosciences 7 (2020): 29.
[4] Bruce, A. Gregory, Peter S. Linsley, and Timothy M. Rose. "Oncostatin M." Progress in growth factor research 4.2 (1992): 157-170.
[5] Yoshimura, Akihiko, et al. "Mouse oncostatin M: an immediate early gene induced by multiple cytokines through the JAK-STAT5 pathway." The EMBO journal 15.5 (1996): 1055-1063.
[6] Botelho, Fernando M., et al. "Pulmonary expression of oncostatin M (OSM) promotes inducible BALT formation independently of IL-6, despite a role for IL- 6 in OSM-driven pulmonary inflammation." The Journal of Immunology 191.3 (2013): 1453-1464.
[7] Mosley, Bruce, et al. "Dual oncostatin M (OSM) receptors: cloning and characterization of an alternative signaling subunit conferring OSM-specific receptor activation." Journal of Biological Chemistry 271.51 (1996): 32635-32643.
[8] Grant, Susan L., and C. Glenn Begley. "The oncostatin M signalling pathway: reversing the neoplastic phenotype?" Molecular Medicine Today 5.9 (1999): 406-412.
[9] Masjedi, Ali, et al. "Oncostatin M: A mysterious cytokine in cancers." International Immunopharmacology 90 (2021): 107158.
[10] Caligiuri, Alessandra, et al. "Oncostatin M: From intracellular signaling to therapeutic targets in liver cancer." Cancers 14.17 (2022): 4211.
[11] M Stephens, Jacqueline, and Carrie M Elks. "Oncostatin M: potential implications for malignancy and metabolism. "Current pharmaceutical design 23.25 (2017): 3645-3657.
[12] Douglas, Andrea M., et al. "Oncostatin M induces the differentiation of breast cancer cells." International journal of cancer 75.1 (1998): 64-73.
[13] Junk, Damian J., et al. "Oncostatin M promotes cancer cell plasticity through cooperative STAT3-SMAD3 signaling." Oncogene 36.28 (2017): 4001-4013.
[14] West, N. R., J. I. Murray, and P. H. Watson. "Oncostatin-M promotes phenotypic changes associated with mesenchymal and stem cell-like differentiation in breast cancer." Oncogene 33.12 (2014): 1485-1494.
[15] Halfter, Hartmut, et al. "Inhibition of growth and induction of differentiation of glioma cell lines by oncostatin M (OSM)." Growth Factors 15.2 (1998): 135-147.
[16] Xue, Jingwen, et al. "TCF-3-mediated transcription of lncRNA HNF1A-AS1 targeting oncostatin M expression inhibits epithelial-mesenchymal transition via TGFβ signaling in gastroenteropancreatic neuroendocrine neoplasms." Aging (Albany NY) 13.10 (2021): 14065.
[17] Guihard, Pierre, et al. "Induction of osteogenesis in mesenchymal stem cells by activated monocytes/macrophages depends on oncostatin M signaling." Stem cells 30.4 (2012): 762-772.
[18] Hui, Wang, et al. "A model of inflammatory arthritis highlights a role for oncostatin M in pro-inflammatory cytokine-induced bone destruction via RANK/ RANKL." Arthritis Res Ther 7 (2004): 1-8.
[19] Le Goff, Benoit, et al. "Oncostatin M acting via OSMR, augments the actions of IL-1 and TNF in synovial fibroblasts." Cytokine 68.2 (2014): 101-109.
[20] West, Nathaniel R., et al. "Oncostatin M drives intestinal inflammation and predicts response to tumor necrosis factor-neutralizing therapy in patients with inflammatory bowel disease." Nature medicine 23.5 (2017): 579-589.
[21] Ito, Hiroaki. "IL-6 and Crohn's disease." Current Drug Targets-Inflammation & Allergy 2.2 (2003): 125-130.
[22] Verstockt, Sare, Bram Verstockt, and Séverine Vermeire. "Oncostatin M as a new diagnostic, prognostic and therapeutic target in inflammatory bowel disease (IBD)." Expert Opinion on Therapeutic Targets 23.11 (2019): 943-954.
[23] Albasanz-Puig, Adaia, et al. "Oncostatin M is expressed in atherosclerotic lesions: a role for Oncostatin M in the pathogenesis of atherosclerosis." Atherosclerosis 216.2 (2011): 292-298.
[24] Kubin, Thomas, et al. "The role of oncostatin M and its receptor complexes in cardiomyocyte protection, regeneration, and failure." International Journal of Molecular Sciences 23.3 (2022): 1811.
[25] Repovic, Pavle, et al. "Oncostatin-M induction of vascular endothelial growth factor expression in astroglioma cells." Oncogene 22.50 (2003): 8117- 8124.
[26] Gusakova, Anna M., et al. "Association of increased oncostatin M with adverse left ventricular remodeling in patients with myocardial infarction." Journal of Medical Biochemistry 41.4 (2022): 441.
[27] Han, Hui, et al. "Oncostatin M promotes infarct repair and improves cardiac function after myocardial infarction." American journal of translational research 13.10 (2021): 11329.
[28] Richards, Carl D. "The enigmatic cytokine oncostatin m and roles in disease." International Scholarly Research Notices 2013 (2013).
[29] Guo, Sen, et al. "Oncostatin M confers neuroprotection against ischemic stroke." Journal of Neuroscience 35.34 (2015): 12047-12062.
[30] Sanchez-Infantes, David, et al. "Oncostatin m is produced in adipose tissue and is regulated in conditions of obesity and type 2 diabetes. "The Journal of Clinical Endocrinology & Metabolism 99.2 (2014): E217-E225.
[31] Miyaoka, Yuichiro, et al. "Oncostatin M inhibits adipogenesis through the RAS/ERK and STAT5 signaling pathways." Journal of Biological Chemistry 281.49 (2006): 37913-37920.
[32] Zhou, Yue, et al. "Blockage of oncostatin M-induced LDL receptor gene transcription by a dominant-negative mutant of C/EBPβ." Biochemical Journal 397.1 (2006): 101-108.
[33] Morikawa, Yoshihiro. "Oncostatin M in the development of the nervous system." Anatomical science international 80 (2005): 53-59.



