武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
CD73新机制揭示:调控血栓炎症与癌症免疫治疗的双刃剑效应
1395 人阅读发布时间:2025-03-21 15:55
在炎症与凝血相互交织的复杂生理病理过程中,嘌呤信号通路扮演着关键角色。其中,CD73作为生成抗炎性腺苷的关键血管酶,其在血栓炎症(thromboinflammation)中的作用一直是未被充分探索的领域。2024年12月在美国血液学会年会上研究人员分享的最近研究成果揭示了CD73在调节先天免疫激活以及保护机体免受血栓炎症损伤中的重要作用,为这一领域的研究带来了新的曙光。
1. CD73的结构
2. CD73的分布
3. CD73的功能
4. CD73与肿瘤
5. CD73临床研究意义
1. CD73的结构
CD73又称胞外-5’-核苷酸酶(Ecto-5’-Nucleotidase),是由NT5E基因编码的一种细胞表面,是催化AMP形成胞外腺苷的主要酶 [1]。人CD73的基因位于染色体6q14-921。CD73的进化相当保守,人CD73的cDNA序列与鼠的cDNA序列有86%的同源性 [2]。人CD73前体蛋白由574个氨基酸残基组成。CD73分子N末端第1-26位氨基酸残基及C末端第550-574位氨基酸残基被剪切后,第27-549位氨基酸残基序列即为成熟CD73,形成1个分子量约为70 kDa亚单位,由两个亚单位构成具有生物活性的同质二聚体,亚基间通过非共价键连接(图1)。N 端中的26个氨基酸信号肽协调结合两个催化性二价金属离子(Zn2 +和Co2 +)。C端为AMP提供了结合位点[3]。C端氨基酸序列是GPI锚定序列,其中第523位丝氨酸作为锚定位点,通过GPI锚定在细胞外膜。这个Ser-523残基与复杂的寡聚糖和鞘脂神经鞘醇基相连。值得注意的是,CD73并没有蛋白片段嵌入细胞膜内。
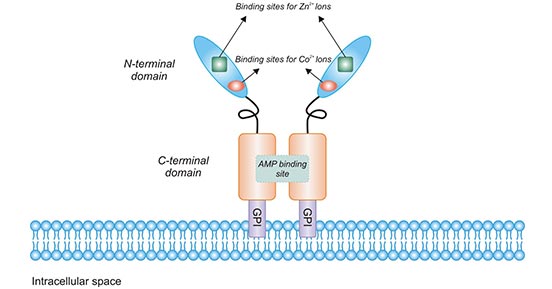
图1. The structure of CD73
*图片源于参考文献[4]。
另外,CD73除了锚定在细胞膜上的形式外,还存在一种截短的可溶性形式。可溶性CD73保留了ecto-5’核苷酸酶活性 [5]。这种可溶性形式可通过磷脂酰肌醇特异性磷脂酶水解GPI锚蛋白或蛋白水解酶从膜上脱落,并在血液和其他生物流体中自由循环 [6]。可溶性核苷酸酶可能代表了一种重要的辅助效应系统,用于局部失活急性升高的核苷酸,特别是在损伤和炎症部位 [4]。
2. CD73的分布
CD73广泛表达于人体组织细胞表面,包括肝细胞、成纤维细胞、内皮细胞、淋巴细胞和神经胶质细胞、近端肾小管上皮细胞等。如图2所示,外圆描绘的是人类蛋白质图谱项目报告中通过免疫组织化学方法检测到CD73蛋白的各种组织和细胞类型。注意,眼中的表达是基于文献报道的。内圈描绘的是基于人类蛋白质图谱数据的人类NT5E基因表达(丰度顺序)。
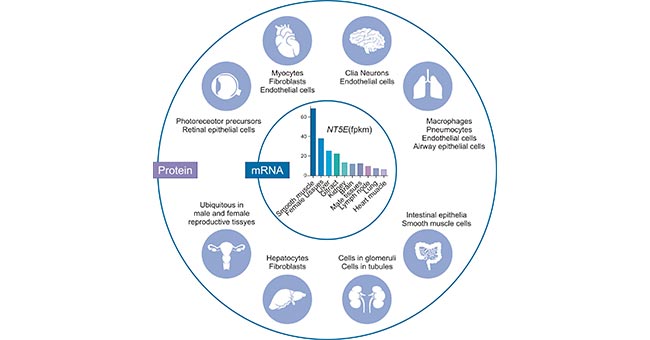
图2. Tissue-specific expression of human CD73
*图片源于参考文献[1]。
此外,CD73在人类脐血B细胞中的表达较低,在婴儿长到6个月大时其表达增加到成人水平。CD73表达于约75%的成人外周血B淋巴细胞,在人类T淋巴细胞成熟期间其表达也增加。CD73表达于大约15%的CD4-和50%的CD8+外周T淋巴细胞,并且所有的CD73+T淋巴细胞均为共刺激分子CD28阳性。在胸腺细胞上,CD73的酶活性几乎不可测出,但在部分外周血、脾脏或淋巴结T淋巴细胞上可以很容易检测到。
3. CD73的功能
CD73是一种代谢免疫检查点,可协调细胞外腺苷水平的关键稳态平衡。它经过N-连接糖基化和二硫键介导的同质二聚化,并通过GPI锚定于细胞膜表面,是细胞外嘌呤代谢通路中的限速酶之一 [7]。它存在于多种细胞类型的表面,包括内皮细胞、淋巴细胞、基质细胞和肿瘤细胞。它的酶促活性与胞外磷酸酶(CD39)紧密相关,CD39可产生AMP,而AMP是CD73的作用底物 [8]。CD73产生的细胞外腺苷可通过与腺苷受体(A1R、A2AR、A2BR和A3R)相互作用来激活下游G蛋白偶联信号并调节腺苷酸环化酶(AC)活性,或者通过平衡核苷转运蛋白(ENTs)将其转运至细胞内。如图3 所示,腺苷也可以调节磷脂酶C(由A1R,A2BR和A3R激活)、MAP激酶(由所有AR亚型激活),PI3K(由A1R和A3R激活),钾(KATP)和钙通道(由A1R激活)。在腺苷受体调节的众多生理反应中,上皮离子与液体转运、组织屏障维持、缺氧、局部缺血预处理和炎症已被证实与CD73活性密切相关 [9]。
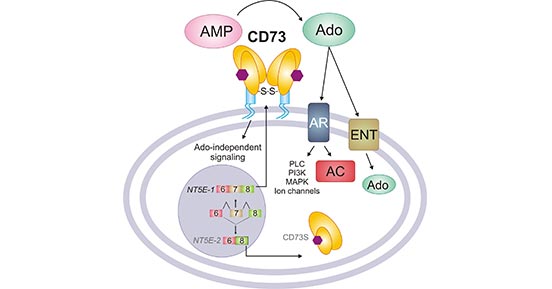
图3. The function of CD73
*图片源于参考文献[1]。
4、CD73与肿瘤
肿瘤微环境中代谢活跃,其中含有丰富的腺苷,腺苷是一种有效的免疫抑制分子,可以强有力地抑制各种免疫细胞,特别是T细胞增殖、细胞毒性和细胞因子的产生的抑制效应,从而抑制抗原呈递细胞(APC),促进Treg细胞的增殖和抑制免疫活性,刺激MDSC和巨噬细胞M2极化。此外,腺苷可以诱导免疫抑制细胞,例如调节性T细胞(Tregs)和骨髓来源的细胞(MDSCs),除这些免疫抑制功能外,腺苷还可以促进癌细胞的增殖、血管生成和转移。腺苷的促肿瘤作用均由在各种细胞上表达的腺苷受体介导 [10]。腺苷的产生过程依赖CD39降解ATP产生单磷酸腺苷(AMP),然后CD73将AMP转化为免疫具有免疫抑制作用的腺苷,在T细胞和NK细胞、树突状细胞(DC)、骨髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM)水平上阻断抗肿瘤免疫监测,而且CD73催化是腺苷产生的主要途径 [11]。
大量研究证实,肿瘤细胞也可以表达CD73并释放腺苷,它的表达和活性与肿瘤的侵袭和转移密切相关 [12][13]。而且肿瘤细胞中,由CD73产生的胞外腺苷足以介导免疫逃逸,促进肿瘤的生长和转移。除了肿瘤细胞对CD73的免疫调节外,CD73还影响肿瘤发生的多个方面,例如增殖、粘附、血管生成和转移。它通过调节细胞周期、凋亡和EGFR、β-catenin / cyclin D1、VEGF和AKT / ERK等信号通路来促进肿瘤细胞的增殖。在不依赖于其酶促功能的情况下,CD73还可以促进细胞间粘附、迁移及癌细胞侵袭。
CD73-腺苷介导的免疫抑制,可以控制压力过大或受损的组织微环境中的炎症反应。CD73表达的缺乏可能暗示组织微环境内的生理性伤口愈合和免疫调节。然而,在肿瘤微环境(TME)内,代谢压力随着肿瘤的进展而积累,这导致CD73在包括乳腺癌,转移性黑素瘤和卵巢癌在内的癌症中表达和活性失调 [14]。肿瘤内CD73的过度表达不仅会导致转移和蒽环类药物耐药,而且还会由于腺苷生成失调而导致免疫逃逸。由于这些原因,如今将CD73抑制剂与包括抗PD-1 /抗PD-L1治疗在内的现有癌症治疗方法结合用于癌症免疫治疗。
5. CD73临床研究意义
罕见病的突破性发现:通过对携带CD73基因功能丧失型突变的罕见病患者的研究,首次确认了这些患者体内CD73酶活性的缺失,并发现其与血栓形成风险的显著增加密切相关。这一发现不仅为罕见的动脉钙化疾病提供了新的病理生理机制解释,也为血栓炎症相关疾病的临床诊断和治疗提供了新的靶点。
血栓炎症的潜在治疗靶点:在动物模型中,CD73的遗传性缺失或抑制均导致静脉血栓形成风险增加,且这一现象可通过外源性腺苷生成酶(apyrase)或腺苷2A受体激动剂(CGS21680)的干预得到缓解。这表明CD73及其下游的腺苷信号通路在调节血栓炎症过程中发挥着关键作用,为开发针对血栓炎症的新型治疗策略提供了有力的理论依据。
对癌症治疗的警示与思考:鉴于CD73抑制剂正在作为免疫检查点抑制剂在癌症临床试验中进行测试,本研究的发现提醒我们在癌症治疗中需谨慎评估CD73抑制剂可能引发的血栓炎症风险。这对于优化癌症治疗方案,降低治疗相关并发症具有重要的临床指导意义,尤其是在众多癌症患者本身即处于高凝状态的背景下。
CD73在血栓炎症中的关键作用的发现,不仅丰富了我们对这一靶点的认识,更为相关疾病的临床干预带来了新的希望和挑战。未来的研究将进一步探索CD73在不同疾病状态下的具体作用机制,并评估其作为治疗靶点的潜力与风险,以期为血栓炎症及相关疾病的患者带来更精准、更有效的治疗方案。
CD73蛋白
● Recombinant Human 5'-nucleotidase(NT5E) (Active) (Code: CSB-MP723415HU)
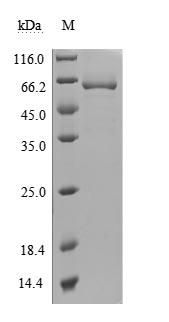
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
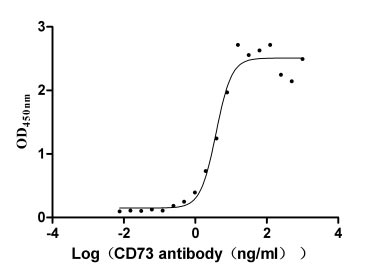
Immobilized CD73 at 2 μg/ml can bind Anti- CD73 Rabbit Monoclonal Antibody(CSB-RA978310A0HU), the EC50 is 3.212-4.525 ng/ml.
参考文献:
[1] Marquet Minor, Karel P. Alcedo, Rachel A. Battaglia, et al. Cell type- and tissue-specific functions of ecto-5´-nucleotidase (CD73) [J]. Am J Physiol Cell Physiol. 2019.
[2] Pouya Joolharzadeh, Cynthia St Hilaire. CD73 (Cluster of Differentiation 73) and the Differences Between Mice and Human [J]. Arterioscler. Thromb. Vasc. Biol. 2019.
[3] Strater, N. Ecto-50-nucleotidase: Structure function relationships [J]. Purinergic Signal. 2006, 2, 343–350.
[4] Luca Antonioli, Gennady G. Yegutkin, Pál Pacher, et al. Anti-CD73 in Cancer Immunotherapy: Awakening New Opportunities [J]. Trends in Cancer. 2016, 2(2):95-109.
[5] Antonioli, L. et al. CD39 and CD73 in immunity and inflammation [J]. Trends Mol. Med. 2013, 19, 355–367.
[6] Yegutkin, G.G. Nucleotide- and nucleoside-converting ectoenzymes: Important modulators of purinergic signalling cascade [J]. Biochim. Biophys. Acta. 2008, 1783, 673–694.
[7] Alcedo KP, Guerrero A, Basrur V, et al. Tumor‐selective altered glycosylation and functional attenuation of CD73 in human hepatocellular carcinoma [J]. Hepatology Communications In Press. 2019.
[8] Antonioli L, Pacher P, Vizi ES, et al. CD39 and CD73 in immunity and inflammation [J]. Trends Mol Med. 2013, 19:355-367.
[9] Borea PA, Gessi S, Merighi S, et al. Pharmacology of Adenosine Receptors: The State of the Art [J]. Physiol Rev. 2018, 98: 1591‐1625.
[10] Ochoa de Olza M, Navarro Rodrigo B, Zimmermann S, et al. Turning up the heat on non-immunoreactive tumours: opportunities for clinical development [J]. The Lancet Oncology. 2020, 21(9):e419-e30.
[11] Vijayan D, Young A, Teng MWL, et al. Targeting immunosuppressive adenosine in cancer [J]. Nature reviews Cancer. 2017, 17(12):709-24.
[12] Bin Zhang. CD73: A novel target for cancer immunotherapy [J]. Cancer Res. 2010, 70(16): 6407–6411.
[13] Chen S, Wainwright DA, Wu JD, et al. Cd73: an emerging checkpoint for cancer immunotherapy [J]. Immunotherapy. 2019, 11:983-997.
[14] Meejeon Roh, Derek A Wainwright, Jennifer D Wu, et al. Targeting CD73 to augment cancer immunotherapy [J]. Current Opinion in Pharmacology. 2020, 53:1–11.
[15] Bertrand Allard, Maria Serena Longhi, Simon C. Robson, et al. The ectonucleotidases CD39 and CD73: Novel checkpoint inhibitor targets [J]. Immunological Reviews. 2017, 276: 121–144.



