武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
白血病抑制因子(LIF)只作用于白血病吗?
1007 人阅读发布时间:2021-07-12 15:23
白血病抑制因子(LIF)属于IL-6超家族的细胞因子。LIF的名字源于其在培养中抑制骨髓性白血病细胞增殖的能力[1]。随着对LIF研究的深入,越来越多的证据表明,LIF不仅在白血病中发挥作用。那么,LIF究竟是什么?它又是如何发挥生物学功能的?除了白血病外,它还与哪些疾病有关?
1、LIF是如何发现的?
2、LIF的结构是什么?
3、LIF是如何发挥生物学功能的?
4、LIF与疾病
- LIF与白血病
- LIF与癌症
5、LIF相关产品
1、LIF是如何发现的?
LIF从发现、克隆至今已经33年。19世纪80年代已发现了一些调节造血细胞增殖和分化的细胞因子,如粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF),Multi-CSF(IL-3)和干扰素-γ(IFN-γ)等。这些细胞因子的共同特点是:既能促进造血细胞的分化,又能刺激它们的增殖。也就是说这些细胞因子在促进白血病细胞分化的同时,也会大量增加白血病细胞的数量,这样可能会加重白血病的病情,而不是治疗白血病。所以,科学家试图仍然需要找到一种只诱导白血病细胞分化,但不促进白血病细胞增殖的细胞因子来治疗白血病。
1969年,在体外构建来自SL品系小鼠的自发性骨髓性白血病系时,研究人员发现,正常细胞的培养液能诱导M1白血病细胞系分化为成熟的巨噬细胞或粒细胞。研究人员将培养液中这些未知的诱导成分统称为分化刺激因子,或D因子(D-factors)[2]。1981年[3]和1984年[4]科学家们分别从小鼠Krebs肉瘤细胞和小鼠L929成纤维细胞的培养液中发现了巨噬细胞和粒细胞诱导剂-2(MGI-2)和一种D因子。两者都能诱导M1骨髓性白血病细胞而不刺激正常造血细胞的增殖。
紧接着在1987年,澳大利亚皇家墨尔本医院沃尔特与伊丽莎医学研究所(Walter and Eliza Hall Institute (WEHI), Royal Melbourne Hospital)的Donald Metcalf实验室从小鼠Krebs肉瘤细胞培养液中分离出可以诱导小鼠M1髓系白血病细胞分化的蛋白,因该蛋白具有抑制M1髓系白血病细胞增殖的作用,因而被命名为白血病抑制因子。同时发现,该蛋白不能刺激正常髓系前体细胞的增殖。Donald Metcalf等认为LIF与前面所发现的MGI-2和D-因子是同一种物质,因他们最大的共同点是均可诱导小鼠M1髓系白血病细胞向巨噬细胞分化。至此,LIF蛋白被正式发现和命名,MIG-2和D-因子为其别名。随后,Donald Metcalf实验室分别于1987年和1988年克隆出表达小鼠LIF和人LIF的基因[5] [6]。
2、LIF的结构是什么?
如图1所示,人和小鼠的LIF基因分别位于22q14和11A1-A2染色体上,长度分别为6.0和6.3kb,含有61/3、592/3和136个氨基酸的三个外显子[7],编码区序列高度保守,同源性为78-94%。分子内的二硫键对维持LIF分子的结构和生物活性起着重要作用。LIF的分子量和电荷因糖基化程度不同而不同,分子量为38-64kDa,IP为8.6-9.2。LIF在体外的生物功能似乎与糖基化程度无关,但糖基化是否会影响LIF在体内的稳定性和功能还有待确定。人和小鼠的LIF在氨基酸水平上有78%的同源性,人的LIF对小鼠来源的细胞有类似的活性,而小鼠的LIF对人的细胞作用较弱。
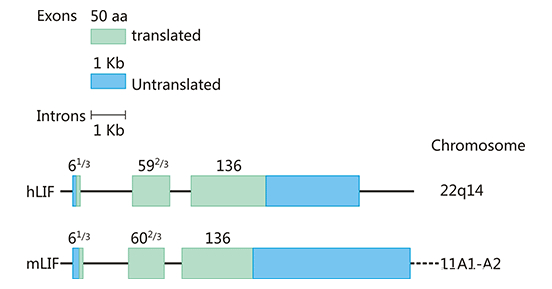
Figure 1. The structure of human and mouse LIF gene
*图片来源于参考文献7。
3、LIF是如何发挥生物学功能的?
LIF可在不同的细胞中表达,包括活化的T细胞、单核细胞、胶质细胞、肝脏成纤维细胞、骨髓基质细胞、胚胎干细胞、胸腺上皮细胞和许多其他细胞。它是一种IL6类细胞因子,可通过抑制分化影响细胞生长。LIF的作用是通过一个高亲和力的受体复合物介导的,该复合物由一个低亲和力的LIFRβ(也称为LIFR)和一个高亲和力的亚单位gp130组成。LIFRβ是一个含有单次跨膜结构域的蛋白,是细胞因子受体中最长的,在其胞外段含有八个不同的结构域[8][9]。
LIF与LIFRβ结合后的复合物会与gpl30进一步非共价结合,形成亲和力高的异质受体复合物(图2)。在大多数细胞类型中,LIF、LIFRβ和gpl30高亲和力复合物的形成是信号转导所必须的。异质二聚体受体复合物本身没有内在的酪氨酸激酶活性。但LIFRβ-gp130-LIF三聚体复合物的细胞质域会与Janus(JAK)激酶家族中至少三个成员相关联,特别是JAK1、JAK2和TYK2。接着,被激活的JAK激酶通过磷酸化触发至少三个信号途径,包括STAT途径、p21ras/MAP激酶途径和PI-3激酶途径。

Figure 2. Structure of the LIF receptor and activation of the JAK-STAT3 signaling pathway
*图片来源于参考文献10。
如图2所示,可溶性细胞因子LIF与低亲和力的LIFRβ-gp130(中间)结合,使它们二聚体化形成高亲和力的LIFRβ-gp130-LIF复合物(左图)。该复合物会募集细胞内的JAK激酶(Jak1),这些激酶相互自动磷酸化,进一步募集转录因子STAT3。磷酸化后的STAT3会二聚体化并进入细胞核。此外,LIFRβ-gp130-LIF复合物也能激活ERK和PI3K途径。STAT3磷酸化后的二聚体会与包括SOCS3在内的各种基因启动子结合,启动其转录。SOCS3蛋白可以与LIFRβ-gp130-LIF复合物结合,阻断JAK激酶的活性,从而抑制LIF介导的STAT3信号传导途径(右图)。
4、LIF与疾病
白血病抑制因子(LIF)是一种具有多种生物功能的细胞因子,可参与诱导正常和骨髓性白血病细胞的造血分化及神经元细胞分化,调节肾脏发育过程中间质向上皮的转化,除此之外,还可能在母胎界面的免疫耐受中发挥作用。白血病抑制因子,顾名思义,肯定是与白血病和骨髓性白血病脱不了干系。但除此之外,越来越多的研究指出LIF在癌症中也有强大的功能,如胰腺癌和乳腺癌。
4.1、LIF与白血病
白血病是由造血细胞的增殖和分化过程失去控制导致的。科学家们一直在寻找能够促进白血病细胞分化并同时抑制其增殖的细胞因子或药物来治疗白血病[11]。
尽管LIF被确定为骨髓性白血病分化诱导因子,但它对造血细胞的影响却少得令人吃惊。LIF常常对造血系统中的肿瘤细胞显示出抑制作用,并诱导这些肿瘤细胞的分化。在小鼠模型中,LIF抑制白血病M1细胞的增殖,并诱导其转变为巨噬细胞表型,如表达Fc受体和获得吞噬能力。LIF对单核细胞的分化也有超级诱导作用。LIF与GM-CSF、G-CSF或IL-6协同作用,抑制HL-60和U937细胞的生长并诱导其分化。LIF能增强IL-3对造血干细胞(巨核细胞的前体)的有丝分裂作用,并增加体内巨核细胞和血小板的数量。LIF还能促进成肌细胞的增殖。
4.2、LIF与癌症
白血病抑制因子(LIF)是一种参与多个生理过程的细胞因子,包括调节细胞分化、新生和存活。目前, LIF(和LIFR)的表达已经在许多实体瘤中被注意到,包括乳腺癌、皮肤结直肠癌和鼻咽癌。LIF参与了癌症生长和进展的一些关键过程,包括免疫耐受、PNI、化疗和放射抗性、癌症干细胞样表型维持、EMT和TME发展(图3)。

Figure 3. Cancer-promoting cellular functions of LIF
*图片来源于参考文献12。
如前所述,LIF是一种广泛表达的细胞因子,具有不同的糖基化模式。而且LIF受体存在于许多不同的组织中,包括肝脏、中枢神经系统、巨噬细胞、骨骼、肾脏、胎盘、胚胎的ICM和子宫上皮。LIF可以通过一些反应使STAT3磷酸化。然后,磷酸化的STAT3形成二聚体并转入细胞核并激活目的基因转录。LIF-JAK/STAT3是胰腺导管腺癌(PDAC)、CRC、卵巢癌和非小肺细胞癌(NSCLC)的一个公认的信号通路。此外,LIF还被证明可以激活其他信号通路,如YAP/TEAD和AKT/mTOR [13]。
以PDAC为例,有一些初步研究结果支持其在PDAC促进机制中的作用。在PDAC中,越来越多的研究表明,LIF作为CAFs分泌的自分泌因子,能够自我刺激而不受TGF-β的影响。此外,它也是ECM重塑、TME成分的招募和胰腺癌细胞生长的旁分泌刺激因子[14] [15]。
5、LIF相关产品
Recombinant Human LIF, partial (Active) (CSB-MP012928HUd9)
Recombinant Human LIFR, partial (Active) (CSB-MP012929HUi9)
LIF Antibody (WB, ELISA) (CSB-PA004761)
LIFR Antibody (ELISA, WB, IHC, IF) (CSB-PA012929LA01HU)
Human LIF ELISA kit (CSB-E04651h)
参考文献:
[1] Catalán, Victoria (2018). Obesity || Inflammatory and Oxidative Stress Markers in Skeletal Muscle of Obese Subjects. , (), 163–189.
[2] Ichikawa Y. Differentiation of a cell line of myeloid leukemia. J Cell Physiol. 1969; 74(3):223-34.
[3] Lipton JH, Sachs L. Characterization of macrophage- and granulocyte-inducing proteins for normal and leukemic myeloid cells produced by the Krebs ascites tumor. Biochim Biophys Acta. 1981; 673(4):552-69.
[4] Tomida M, Yamamoto-Yamaguchi Y, Hozumi M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 1984; 259(17):10978-82.
[5] Gearing DP, Gough NM, King JA, . Molecular cloning and expression of cDNA encoding a murine myeloid leukaemia inhibitory factor (LIF). EMBO J. 1987; 6(13):3995-4002.
[6] Gough NM, Gearing DP, King JA, Willson TA, . Molecular cloning and expression of the human homologue of the murine gene encoding myeloid leukemia-inhibitory factor. Proc Natl Acad Sci U S A. 1988; 85(8):2623-7.
[7] Katherine A.Fitzgerald, Luke A.J.O'Neill, Andy J.H.Gearing, Robin E.Callard. The Cytokine FactsBook and Webfacts (Second Edition). 2001, Pages 346-350.
[8] Gearing DP, Thut CJ, VandeBos T, . Leukemia inhibitory factor receptor is structurally related to the IL-6 signal transducer, gp130 [J]. EMBO J. 1991 Oct; 10(10):2839-48.
[9] Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF) [J]. Cytokine Growth Factor Rev. 2015 Oct; 26(5):533-44.
[10] Stewart, Colin L. (2018). Encyclopedia of Reproduction || Leukemia Inhibitory Factor. , (), 405–411.
[11] Hozumi M. Fundamentals of chemotherapy of myeloid leukemia by induction of leukemia cell differentiation. Adv Cancer Res. 1983; 38:121–169.
[12] Wrona E, Potemski P, Sclafani F, . Leukemia Inhibitory Factor: A Potential Biomarker and Therapeutic Target in Pancreatic Cancer [J]. Arch Immunol Ther Exp (Warsz). 2021. Feb 25; 69(1): 2.
[13] McLean K, Tan L, Bolland DE, . Leukemia inhibitory factor functions in parallel with interleukin-6 to promote ovarian cancer growth [J]. Oncogene. 2019 Feb; 38(9):1576-1584.
[14] Fu Y, Liu S, Zeng S, . The critical roles of activated stellate cells-mediated paracrine signaling, metabolism and onco-immunology in pancreatic ductal adenocarcinoma [J]. Mol Cancer. 2018 Feb 19; 17(1):62.
[15] Ligorio M, Sil S, Malagon-Lopez J, . Stromal Microenvironment Shapes the Intratumoral Architecture of Pancreatic Cancer [J]. Cell. 2019 Jun 27; 178(1): 160-175.e27.



