武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
CCR6:“专一性”趋化因子受体,炎症性和消化系统肿瘤药物研究的潜力靶标!
1031 人阅读发布时间:2024-02-27 17:14
2024年1月3日,一篇综述“Research progress on the role of tumor-associated macrophages in tumor development and their use as molecular targets”详细阐述了肿瘤相关巨噬细胞(TAMs)在肿瘤进程中的重要性 [1]。其中,CCR6-CCL20轴对TAMs和Treg的招募和极化有着显著影响。例如,在结肠癌中,TAMs分泌的CCL20招募CCR6+的Treg细胞,形成免疫抑制的微环境,促进肿瘤的发展。CCR6是一种G蛋白偶联趋化因子受体,与CCL20紧密结合形成一对具有高度亲和力和“专一性”的趋化因子受配体。大量研究表明,CCR6与多种炎症性疾病相关,并且在多种消化系统肿瘤的发生与发展中发挥重要作用。CCR6作为一种独特的趋化因子受体,有望为未来的靶向药物研发提供新的策略。今天,让我们深入了解这个“专一性”趋化因子受体CCR6!
1. 什么是趋化因子家族?
趋化因子家族是一组具有多种生物学功能的小分子活性蛋白,能够被多种细胞分泌,其主要功能是引导细胞移动。人体内已发现50余种趋化因子,分为四个亚型:C(XCL1-XCL2)、CC(CCL1-CCL28)、CXC(CXCL1-CXCL17)和CX3C(CX3C1)。这些趋化因子通过特定的受体(G蛋白偶联七次跨膜受体)与细胞表面结合,引导细胞迁移到生物体内特定的位置。趋化因子受体分为四个亚家族:CXC类受体(CXCR1-CXCR7)、CC类受体(CCR1-CCR10)、XC类受体(XCR1)和CX3C类受体(CX3CR1)。趋化因子和受体往往是一对多或多对一结合关系,即一个趋化因子可以与多个受体结合,一个受体也可以与多个趋化因子结合。然而,人体内存在6种匹配的趋化因子和趋化因子受体,分别为CCL20-CCR6,CCL25-CCR9,CXCL16-CXCR6,CX3CL1-CX3CR1和CXCL12-CXCR4,CXCL13-CXCR5 [1-5]。
2. 什么是CCR6?
2.1 CCR6的结构
CC基序趋化因子受体6(CC motif chemokine receptor 6,CCR6)是一种跨膜G蛋白偶联受体。人类CCR6基因位于染色体6q27,而许多CCR基因位于染色体3p。CCR6具有G蛋白偶联趋化因子受体所具有的氨基酸残基和序列基序特征,其中包括酸性N末端区域中潜在的两个N连接糖基化位点,以及其它两个分别位于细胞外第一和第三个环上的糖基化位点。此外,CCR6的一级结构包括四个高度保守的半胱氨酸残基(两个形成二硫桥,另外两个未形成二硫键)。由于趋化因子受体结构的复杂性,CCR6趋化因子受体的三维空间结构尚未确定,目前仅趋化因子受体CXCR1和CXCR4的高级结构被鉴定。因此,对于趋化因子受体CCR6的结构还有待进一步的探究和认识(图1)[6-9]。
2.2 CCR6的表达和功能
CCR6在淋巴和非淋巴组织中均有表达,其中在脾、淋巴结、阑尾、胰腺中尤为显著,而在胸腺、结肠、小肠、胎儿肝脏和睾丸中较少。此外,CCR6还表达于各种白细胞亚群,包括未成熟树突状细胞(iDC)B细胞、T细胞(促炎Th17细胞,调节性Treg细胞)、NK细胞和中性粒细胞。大量研究揭示,CCR6异常表达与多种疾病相关,包括炎症性肠病、牛皮癣、类风湿关节炎和多发性硬化症,且表达情况与疾病严重程度之间存在很强的相关性。此外,与其它的趋化因受体不同的是,它只与配体CCL20相结合,构成了CCR6/CCL20。近期的研究发现CCR6/CCL20在多种人类肿瘤细胞中高表达,并且与肿瘤的侵袭转移密切相关 [6-9]。
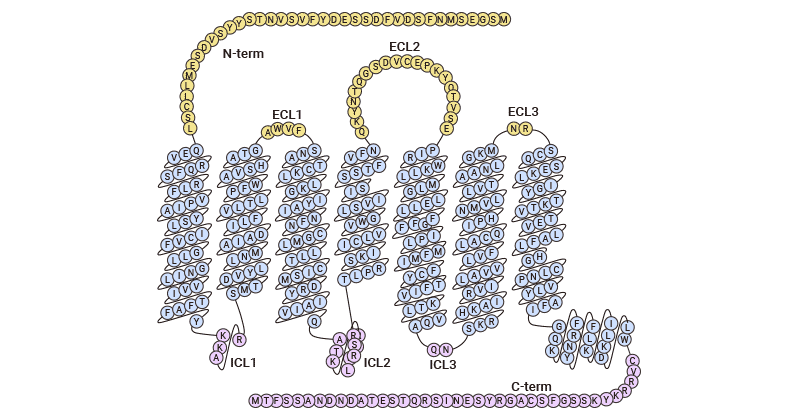
图1. CCR6拓扑结构图 [9]
3. 什么是CCR6的配体?
CC基序趋化因子配体20(CCL20)是已知能与CCR6结合并促使CCR6细胞迁移的配体,具备高亲和力和专一性。CCL20又称巨噬细胞炎症蛋白3a(MIP-3a)或肝脏活化调节因子(LARC),主要由上皮细胞产生,其表达水平在炎症条件下显著增加。CCL20可以受多种细胞因子调控,研究表明IL-1a、IL-1β、IL-17、IL-21、TNF-a、IFN-y等可以诱导CCL20的表达,而IL-10可以下调CCL20的表达。虽然CCL20仍然是CCR6已知的趋化因子配体,然而有研究正在探索其新配体,如人类B-防御素1(HBD-1)和2(HBD-2) [10-12]。
趋化因子通过与趋化因子受体相互结合发挥作用,从而实现各类细胞在系统和组织器官之间的迁移,维护机体的稳态。研究表明,CCL20的N末端是CCR6激活的关键触发位点。CCL20的N末端通过氢键和盐桥与CCR6的ECL2和R421.28侧链相互作用,从而直接将CCL20的N端与CCR6的7次跨膜区结合,这对CCR6的激活至关重要。CCR6/CCL20结合时,其激活的信号非常复杂,目前普遍的解释是Ca2+、P13K/Akt等第二信使被激活,从而激活下游蛋白激酶,引起级联反应,从而促进表达相应趋化因子的细胞发生转移 [13-14]。
4. CCR6相关的信号调控机制
4.1 CCR6促肿瘤微环境T细胞迁移机制
通过建立小鼠结肠癌皮下移植瘤模型的研究发现,在肿瘤组织中有大量表达趋化因子受体CCR6的调节性T细胞浸润。体内外实验表明,小鼠CMT93结肠癌细胞和肿瘤相关巨细胞都分泌CCR6的配体CCL20。在皮下移植瘤的肿瘤微环境中注射重组CCL20能招募大量调节性T细胞,并显著促进肿瘤的发展。最后,使用CD11b-DTR全身选择性敲除巨噬细胞的小鼠模型显示,皮下移植瘤后肿瘤微环境中趋化因子CCL20分泌减少,阻止了调节性T细胞在肿瘤微环境的迁移。总之,小鼠结肠癌模型中,肿瘤相关巨噬细胞通过分泌趋化因子CCL20招募CCR6表达的调节性T细胞,并促进肿瘤的生长。这一发现为未来肿瘤免疫疗法提供了潜在的治疗靶点 [15]。
4.2 CCR6促肿瘤血管形成机制
研究人员利用慢病毒转染技术构建了CCR6敲低和过表达的结肠直肠癌细胞系,相关实验揭示CCR6敲低抑制了血管生成,而CCR6过表达增强了肿瘤血管生成能力。加入重组人CCL20(rhCCL20)增强了对血管生成的促进作用,该效果可被针对hCCL20和CCR6的抗体阻断,表明CCR6促进血管生成依赖于CCL20的分泌。进一步的分子机制研究表明,VEGF-A,angiopoietin-l,angiopoietin-2和MMP9表达上调,其中VEGF-A表达上调最为显著,提示VEGF-A可能是介导CCR6促进肿瘤血管生成的关键分子。采用ERK和PI3K通路的抑制剂(LY294002)处理肿瘤细胞后,VEGFA表达下调,暗示PI3K/AKT通路参与了CCR6介导的血管生成(图2)[16]。
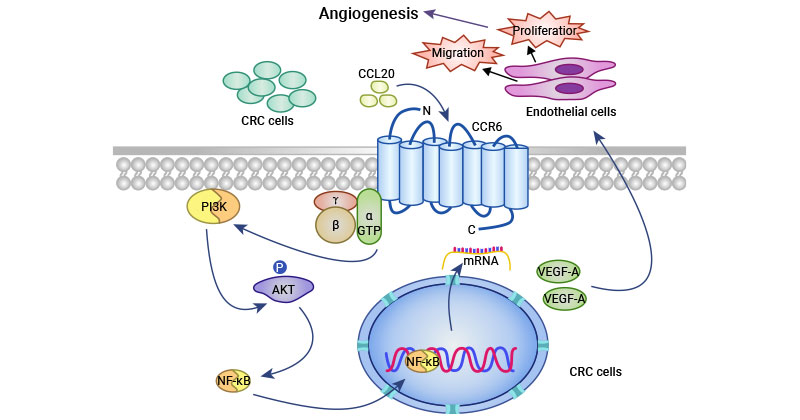
图2. CCR6促肿瘤血管形成机制 [16]
5. CCR6与疾病相关研究
近年来,国内外对CCR6的功能及其在生物体内的作用进行了广泛研究。研究集中在趋化因子受体CCR6以及其配体CCL20(CCR6/CCL20)的相互作用上。这种相互作用在控制炎性疾病、自身免疫性疾病以及肿瘤(尤其是消化系统肿瘤)等疾病过程中扮演着关键角色。这为研究者更好地理解和干预与疾病相关的肿瘤、免疫和炎症过程提供了重要线索。
5.1 CCR6/CCL20和炎症性疾病研究
CCR6/CCL20在炎症性疾病中扮演着关键角色,参与组织破坏并影响疾病严重程度 [9]。在肠道炎症疾病中,CCR6信号可调节巨噬细胞和树突状细胞,影响组织损伤和炎症反应。CCR6缺失可能有助于对抗腹膜炎,减轻细菌感染引起的炎性反应 [9]。此外,CCR6/CCL20信号也在慢性气道炎症中扮演关键作用,影响免疫细胞在炎症部位的聚集 [17]。另外,有研究指出CCR6/CCL20在动脉粥样硬化中具有重要影响,特别是在单核细胞的趋化方面 [18]。CCR6-/-小鼠的实验显示了轻微的动脉粥样硬化受损,暗示CCR6和CCL20或许参与了血管壁的自我调节循环 [18]。除了单核细胞外,其它CCR6+白细胞亚群可能也在动脉粥样硬化的进展中扮演重要角色,其确切作用尚需进一步研究探讨 [19]。
5.2 CCR6/CCL20和自身免疫疾病研究
研究表明,CCR6-/-小鼠在皮肤接触性超敏反应方面表现更为严重,而在退发型超敏反应、急性移植物抗宿主疾病和气道变应性炎症方面表现减轻。此外,在系统性硬化病、HIV、银屑病皮炎等疾病中发现了CCR6的相关性。实验中观察到CCR6和CCL20在病变组织中上调,并与免疫细胞的聚集相关。另一方面,在自身免疫性肝炎和气道变应性炎症模型中,CCR6/CCL20信号可能影响T细胞的迁移和活化。总体而言,CCR6/CCL20通过调节免疫细胞在病变部位的聚集,参与调节免疫应答。尽管如此,其具体作用机制仍未完全阐明 [10, 20-21]。
5.3 CCR6/CCL20和肿瘤研究
CCR6/CCL20的表达已在多种癌症中被发现,主要与结肠癌、胃癌、胰腺癌、肝癌和食管癌等消化系统癌症有关 [22-31]。这些研究主要聚焦于CCR6/CCL20相互作用在促进肿瘤细胞迁移、增殖以及影响肿瘤免疫逃逸等方面。例如,有研究发现在原发性肿瘤标本中,CCR6在远处转移组中显著升高,暗示着可能存在远处异时性转移,然而在肝肺器官的特异性转移中并未发现明显差异 [27]。其它研究表明CCR6/CCL20信号可能通过促进Th9细胞迁移进而增加肿瘤细胞的扩散,而抗CCL20的抑制作用能够减少Th9细胞的趋化能力 [25]。除此之外,CCR6/CCL20相互作用还涉及肿瘤免疫逃逸,其中一些实验研究发现在肿瘤患者中特定类型的Th17细胞增加,这些细胞可能与TGF-β的调控有关 [31]。目前CCR6/CCL20在消化系肿瘤的研究还比较浅显,进一步探讨其在消化系统肿瘤的发生、发展的作用机理,将为相关药物研究带来新策略。
6. CCR6的临床药物研究前景
目前已有两种与CCR6相关的药物,分别是PF-07054894和HG-1112。来自Pfizer Inc.的PF-07054894是一种CCR6拮抗剂,可通过阻断CCR6与其配体的结合,抑制CCR6介导的炎症反应,目前正在溃疡性结肠炎的临床前期试验中。另一种药物HG-1112是一种CCR6和TRPV1的双重调节剂,具有抗炎和镇痛作用,但其在研适应症尚未公开。PF-07054894和HG-1112均为小分子化药物,具有较好的生物利用度和组织渗透性。现在已开发出很多趋化因子受体的小分子抑制剂并应用在临床I到II期的研究中,最为著名的就是CXCR4的小分子化合物针对艾滋病的研究,最近这种小分子抑制剂也在肿瘤转移的临床研究中进行开发。期待CCR6也像CXCR4一样开发出特异性很强的小分子化合物,为炎症性、消化系统疾病、自身免疫性疾病、肿瘤领域带来新的研究方向。
为鼎力协助各药企针对CCR6在炎症性、消化系统疾病、自身免疫性疾病、肿瘤等疾病在临床中的研究,华美CUSABIO推出CCR6活性蛋白(CSB-MP004845HU)和抗体(CSB-RA004845MA1HU)产品,助力您在CCR6机制方面的研究或其潜在临床价值的探索。
华美 CUSABIO CCR6 蛋白
Recombinant Human C-C chemokine receptor type 6(CCR6)-VLPs (Active) Code: CSB-MP004845HU
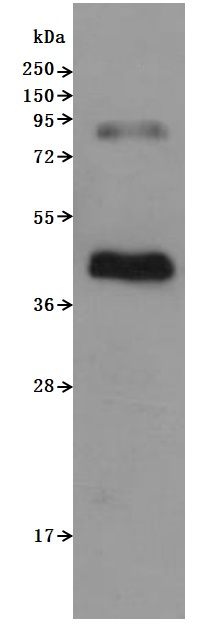
CSB-MP004845HU is detected by Mouse anti-6*His monoclonal antibody. The two bands respectively correspond to monomer, Homodimer.
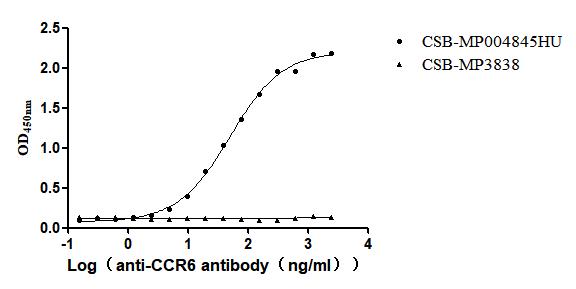
Immobilized Human CCR6 at 10μg/mL can bind Anti-CCR6 recombinant antibody (CSB-RA004845MA1HU). The EC50 is 44.79-56.10 ng/mL.VLPs (CSB-MP3838) is negative control.
华美 CUSABIO CCR6 抗体
CCR6 Recombinant Monoclonal Antibody (ELISA) (CSB-RA004845MA1HU)
参考文献:
[1] Lu, Chenglin, et al. "Research progress on the role of tumor‑associated macrophages in tumor development and their use as molecular targets." International Journal of Oncology 64.2 (2024): 1-12.
[2] Li, Xian, Jiaqi Peng, and Xiulan Su. "Expression of immune regulatory factors, chemokines and growth factors in differentiated gastric cancer cells treated with an anticancer bioactive peptide combined with oxaliplatin." Molecular and Clinical Oncology 20.1 (2024): 1-10.
[3] Chen, Xuyan, et al. "The role of CXCL chemokine family in the development and progression of gastric cancer." International journal of clinical and experimental pathology 13.3 (2020): 484.
[4] Mamazhakypov, Argen, et al. "The role of chemokines and chemokine receptors in pulmonary arterial hypertension." British journal of pharmacology 178.1 (2021): 72-89.
[5] Do, Ha Thi Thu, Chang Hoon Lee, and Jungsook Cho. "Chemokines and their receptors: multifaceted roles in cancer progression and potential value as cancer prognostic markers." Cancers 12.2 (2020): 287.
[6] Wasilko, David Jonathan, et al. "Structural basis for chemokine receptor CCR6 activation by the endogenous protein ligand CCL20." Nature communications 11.1 (2020): 3031.
[7] Martina, Maria Grazia, et al. "Discovery of small-molecules targeting the CCL20/CCR6 axis as first-in-class inhibitors for inflammatory bowel diseases." European Journal of Medicinal Chemistry 243 (2022): 114703.
[8] Isaikina, Polina, et al. "Structural basis of the activation of the CC chemokine receptor 5 by a chemokine agonist." Science Advances 7.25 (2021): eabg8685.
[9] Gómez-Melero, Sara, and Javier Caballero-Villarraso. "CCR6 as a Potential Target for Therapeutic Antibodies for the Treatment of Inflammatory Diseases." Antibodies 12.2 (2023): 30.
[10] Meitei, Heikrujam Thoihen, Nandadeep Jadhav, and Girdhari Lal. "CCR6-CCL20 axis as a therapeutic target for autoimmune diseases." Autoimmunity reviews 20.7 (2021): 102846.
[11] Reichard, Sherwood. The International Cytokine Conference (11th) Held in Dublin (Ireland) on September 20-24 2003 (European Cytokine Network, Volume 14, Number 3, September 2003). 2003.
[12] Lee, Adrian YS, et al. "The relationship between CCR6 and its binding partners: Does the CCR6–CCL20 axis have to be extended?." Cytokine 72.1 (2015): 97-101.
[13] Liu, Kaiwen, et al. "Structural insights into the activation of chemokine receptor CXCR2." The FEBS Journal 289.2 (2022): 386-393.
[14] Murugesan, Vidya, and Senthilkumar Rajagopal. "Modulatory effects of G protein–coupled receptor in hepatocellular carcinoma." Theranostics and Precision Medicine for the Management of Hepatocellular Carcinoma. Academic Press, 2022. 81-95.
[15] Liu, Jinlin, et al. "Tumor-associated macrophages recruit CCR6+ regulatory T cells and promote the development of colorectal cancer via enhancing CCL20 production in mice." PloS one 6.4 (2011): e19495.
[16] Zhu, Cong-cong, et al. "CCR6 promotes tumor angiogenesis via the AKT/NF-κB/VEGF pathway in colorectal cancer." Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease 1864.2 (2018): 387-397.
[17] Bracke, Ken R., et al. "Cigarette smoke-induced pulmonary inflammation and emphysema are attenuated in CCR6-deficient mice." The Journal of Immunology 177.7 (2006): 4350-4359.
[18] Wan, Wuzhou, et al. "Genetic deletion of chemokine receptor Ccr6 decreases atherogenesis in ApoE-deficient mice." Circulation research 109.4 (2011): 374-381.
[19] Wan, Wuzhou, and Philip M. Murphy. "Regulation of atherogenesis by chemokine receptor CCR6." Trends in cardiovascular medicine 21.5 (2011): 140-144.
[20] Comerford, Iain, et al. "An immune paradox: how can the same chemokine axis regulate both immune tolerance and activation? CCR6/CCL20: a chemokine axis balancing immunological tolerance and inflammation in autoimmune disease." Bioessays 32.12 (2010): 1067-1076.
[21] Chung, So-Hyang, et al. "The CC chemokine receptor 6 (CCR6) is crucial for Th2-driven allergic conjunctivitis." Clinical Immunology 161.2 (2015): 110-119.
[22] Nandi, Bisweswar, et al. "Stromal CCR6 drives tumor growth in a murine transplantable colon cancer through recruitment of tumor-promoting macrophages." Oncoimmunology 5.8 (2016): e1189052.
[23] Ohtani, Haruo, Takashi Nakayama, and Osamu Yoshie. "In situ expression of the CCL20–CCR6 axis in lymphocyte‐rich gastric cancer and its potential role in the formation of lymphoid stroma." Pathology international 61.11 (2011): 645-651.
[24] Nandi, Bisweswar, et al. "CCR6, the sole receptor for the chemokine CCL20, promotes spontaneous intestinal tumorigenesis." PloS one 9.5 (2014): e97566.
[25] Kadomoto, Suguru, Kouji Izumi, and Atsushi Mizokami. "The CCL20-CCR6 axis in cancer progression." International journal of molecular sciences 21.15 (2020): 5186.
[26] Cook, Katherine W., et al. "CCL20/CCR6-mediated migration of regulatory T cells to the Helicobacter pylori-infected human gastric mucosa." Gut (2014): gutjnl-2013.
[27] Dellacasagrande, J., et al. "Liver metastasis of cancer facilitated by chemokine receptor CCR6." Scandinavian journal of immunology 57.6 (2003): 534-544.
[28] Rubie, Claudia, et al. "CCL20/CCR6 expression profile in pancreatic cancer." Journal of translational medicine 8 (2010): 1-8.
[29] Lian, Jingyao, et al. "Eomes promotes esophageal carcinoma progression by recruiting Treg cells through the CCL20‐CCR6 pathway." Cancer Science 112.1 (2021): 144-154.
[30] Zhang, X. G., et al. "CCR6 overexpression predicted advanced biological behaviors and poor prognosis in patients with gastric cancer." Clinical and Translational Oncology 18 (2016): 700-707.
[31] Xu, Lin, et al. "In situ prior proliferation of CD4+ CCR6+ regulatory T cells facilitated by TGF-β secreting DCs is crucial for their enrichment and suppression in tumor immunity." PLoS One 6.5 (2011): e20282.



