武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
SIGIRR:一个新的信号受体 TIR 超家族成员,机体炎症、免疫反应的「刹车」分子!
1057 人阅读发布时间:2023-08-16 13:43
近期,Seminars in Immunology 杂志发表了一篇题为 "IL-1R8: A molecular brake of anti-tumor and anti-viral activity of NK cells and ILC" 的文章 [1],该报道揭示 IL-1R8/SIGIRR 是调节 NK 细胞和 ILC 对肿瘤和病毒免疫反应的重要 " 刹车 " 分子。值得关注的是,SIGIRR 是一种新发现的 Toll-IL-1R(TIR)信号受体超家族成员。ILRs(Interleukin-1 receptors)和 TLRs(Toll-like-receptors)亚家族均属于 TIR 家族。
大量研究已证实 SIGIRR 负调控 ILRs 和 TLRs 炎症信号通路,在感染性疾病、肿瘤及自身免疫疾病起调控相关炎症反应的作用。因此,SIGIRR 作为一种新型的抗炎分子,可用来预测炎症和免疫相关的疾病的发展。在临床药物研究中,SIGIRR 也被寄予厚望,有望展现出重要的价值。目前,SIGIRR 作为 TIR 超家族成员,成为机体炎症和免疫反应研究的重要关注靶点!
1. 什么是 Toll-IL-1R(TIR)超家族?
2. 什么是 SIGIRR?
-
2.1 SIGIRR 的结构
-
2.2 SIGIRR 的表达
-
2.3 SIGIRR 的功能
3. SIGIRR 对 TLRs 和 IL-1Rs 信号通路的负向调节机制
4. SIGIRR 在炎症免疫相关性疾病中的作用
-
4.1 SIGIRR 和感染性疾病
-
4.2 SIGIRR 和自身免疫疾病与过敏反应
-
4.3 SIGIRR 和肿瘤
5. SIGIRR 的临床药物研究前景
1. 什么是 Toll-IL-1R(TIR)超家族?
Toll-IL-1R(TIR)是一个新发现的信号受体超家族。1997 年,Medazhitov 等首次发现与果蝇同源的人的 Toll 样蛋白,命名为 Toll 样受体(Toll-like-receptors,TLRs)。由于它与白细胞介素 1 受体(Interleukin-1 receptors,IL-1Rs)在结构、功能、信号转导通路上的诸多相似,所以被归类为一个大的信号受体家族—Toll-IL-1R(TIR)家族 [2]。TLRs 和 IL-1Rs 是重要的天然免疫受体,可以启动天然免疫反应,它们的共同特征是胞质区有个名为 Toll/IL-1R(TIR)结构域的保守序列。目前的研究发现人 TIR 超家族至少包括 3 个不同的群体:Toll 样受体家族、IL-1R 家族、My D88(图 1) [3]。
TLRs 亚家族成员包括多种受体,如 TLR1,TLR2,TLR3,TLR4,TLR5,TLR6,TLR7,TLR8 和 TLR9 等。ILRs 亚家族包括受体 IL-1R1,IL-18R,T1/ST2,IL-1Rrp2 和 IL-1,IL-18,IL-33 的辅助蛋白(Ac P)(IL-1RAcP,IL-18RAcP,IL-1RAcPb),还有其它的 IL-1 家族成员(IL-1F6,IL-1F8,IL-1F9)。许多研究均证实,TIR 信号受体家族的成员在机体对抗外来病原体的天然免疫中起到了重要的作用。在 TIR 家族中都存在一些孤儿受体,它们的配体和功能仍然未知,如 SIGIRR [1-3]。
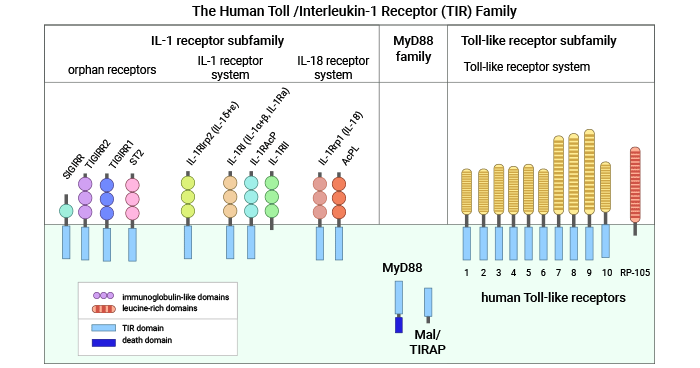
图 1. 人Toll-IL-1R(TIR) 超家族 [3]
2. 什么是 SIGIRR?
2.1 SIGIRR 的结构
单免疫球蛋白白细胞介素 1 受体相关蛋白(Single Ig IL-1-related receptor,SIGIRR),又称白细胞介素 1 受体 8(Interleukin-1 receptor8,IL-1R8),于 1999 年由 Thomassen 等首次发现并命名,属于 TIR 超家族。SIGIRR 基因位于 11 号染色体,该蛋白含有一个单一 Ig 胞外结构域(aa17-112),跨膜结构域(aa117-139),胞内 TIR 保守结构域(aa166-305)和一个 95aa 长度的胞内尾区(图 2)[4-7]。
SIGIRR 和 IL-1R、TLRs 结构相似,但 SIGIRR 结构特殊性表现为:SIGIRR 只有 1 个 Ig 胞外结构域,而 IL-1R 有 3 个;SIGIRR 胞内的 TIR 结构域缺乏传递信号所必须的氨基酸 Ser447 和 Tyr536。由于 SIGIRR 独特的分子结构,所以 SIGIRR 在炎症反应中不能激活下游炎症信号通路 [4-7]。
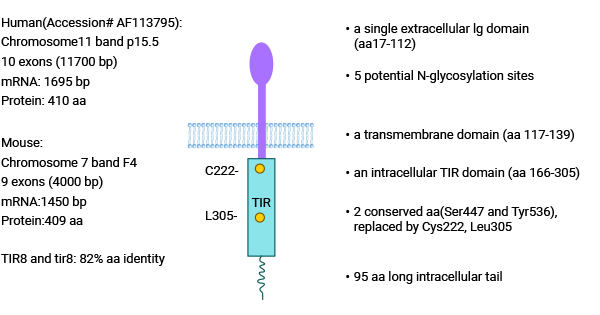
图 2. SIGIRR 的结构 [4]
2.2 SIGIRR 的表达
SIGIRR 广泛表达于多种上皮组织,包括肺脏、肝脏、甲状旁腺、胃肠道和肾脏等组织,其中以胃肠道和肾脏的上皮细胞中含量最为丰富。炎症状态下,SIGIRR 表达水平的降低与 p38 活化增加和泛素化酶 USP13 表达降低有关。此外,当受到内毒素 LPS 刺激时,USP13 表达下调,SIGIRR 的泛素化水平增加,其稳定性降低。SIGIRR 的结构和表达模式在人类的进化中都趋于保守。SIGIRR 在机体大部分组织器官上的广泛性表达为其负性炎症调控机制的发挥奠定了组织基础 [8-10]。
2.3 SIGIRR 的功能
SIGIRR 是一种孤儿受体,其配体目前尚未完全阐明,但有报道称 IL-1F5 在神经胶质细胞中是其配体。SIGIRR 具有抑制 IL-1 家族成员相关 T 细胞分化的信号传导及 TLRs 介导的激活作用的能力。这种对 ILRs 和 TLRs 家族成员信号通路的抑制能力,使得 SIGIRR 在炎症、肿瘤相关性炎症和自身免疫中起着至关重要的调节作用。SIGIRR 的负性调节作用已在不同条件下的小鼠身上得到强有力的证明,并且支持 SIGIRR 与人类疾病相关的临床数据也在不断出现。因此,SIGIRR 在炎症免疫反应中的调节作用具有重要的临床意义 [11-13]。
3. SIGIRR 对 TLRs 和 IL-1Rs 信号通路的负向调节机制
SIGIRR 具有独特的结构,与 TIR 超家族成员的功能完全相反。在许多炎性相关疾病中,SIGIRR 表现出负向调控 TLRs 和 IL-1Rs 信号通路的作用,阻碍炎性信号传递。该调控机制复杂,影响多个下游靶点,包括 IL-1R1、IL-1R5/IL-18Rα、IL-1R4/ST2、TLR4、TLR7、TLR9、TLR3 和 TLR1/2 的活化,并抑制 TIR 结构域诱导的 NF-κB 和 JNK 活化。目前尚未完全阐明 SIGIRR 如何调节 TLR/IL-1R 信号通路的活化机制 [14-16]。
SIGIRR 的抑制作用主要涉及 IL-1 诱导的信号传导、Pam3Cys 诱导的 TLR2 信号通路、内毒素(1ipopolysacharride, LPS)与 Cp G DNA 诱导的 TLR4 和 TLR9,以及 TLR3 和 TLR1/2 信号通路的活化。报道显示,SIGIRR 可能通过两种机制实现其作用:一是胞外 Ig 样区可能干扰 IL-1RI 和 IL-1RAcP 形成二聚体;二是胞内 TIR 结构域干扰 TLR/IL-1R 与衔接蛋白结合如 My D88、IRAK 及 TRAF6 等,从而抑制核转录因子 NF-κB 和 JNK 等的激活(图 3)[17-19] 。
三维模型表明,TIR 结构域尤其是其 BB-环可以与 MyD88 二聚体形成竞争,从而抑制信号。除了 MyD88 依赖的途径外,SIGIRR 还可以通过阻断 TRAM 二聚化的方式来干扰 TRIF 的信号传导。这种作用机制可以影响 TLR3 的信号传导以及 TLR4-TRAM 和 TRIF-TRAM 的相互作用。此外,SIGIRR 还可调节 Th17 细胞和 NK 细胞中的 JNK 和 mTOR 磷酸化以及肠上皮细胞中由 IL-1 或 TLR 激动剂驱动的 mTOR 磷酸化 [20-22]。
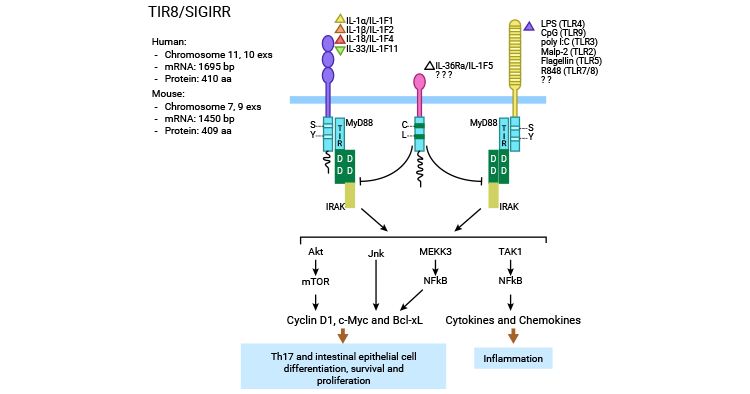
图 3. SIGIRR 的信号调节机制 [22]
4. SIGIRR 在炎症免疫相关性疾病中的作用
近年来,SIGIRR 的负性调控作用在炎症免疫相关性疾病的研究中取得了诸多进展。SIGIRR 可在感染性疾病中,防止因过度的炎症反应而造成的组织损伤,促进感染性疾病的恢复;在自身免疫性疾病中,降低疾病的发生风险以及严重程度;在肿瘤中,通过控制肿瘤相关炎症反应,抑制肿瘤的发生和发展。此外,SIGIRR 可能在协助肿瘤细胞扩散和转移时也发挥了一定的作用。
4.1 SIGIRR 和感染性疾病
SIGIRR 表达异常与机体组织炎症损伤的严重程度相关。例如,在结核分枝杆菌感染中,SIGIRR 基因缺陷小鼠表现出过度的炎症反应和死亡率升高,这是由于 SIGIRR 缺乏导致其对 IL-1 和 TNF-α 抑制效应的解除 [23-24]。
在其他感染模型中,如铜绿假单胞菌、白色念珠菌或烟曲霉菌等引起的急性肺部感染,以及大肠杆菌引起的尿路感染,低表达或沉默的 SIGIRR 会导致机体易感性增加、促炎细胞因子过度释放和死亡率增加 [13]。此外,在 SIGIRR 缺陷小鼠中,β-淀粉样肽诱导的突触和认知功能障碍更为严重,但上调 SIGIRR 表达可以缓解 Abeta 介导的海马突触活动长时程增强(LTP)损伤 [17, 25]。
4.2 SIGIRR 和自身免疫疾病与过敏反应
ILRs 和 TLRs 参与了自身免疫性疾病和过敏性炎症的病理生理机制。其中,IL-1 作为 Th17 分化和活化的关键因子,在多种自身免疫性疾病中发挥着重要作用。SIGIRR 作为抑制剂,可控制 IL-1 依赖性 Th17 的分化、扩增和效应功能,并抑制 T 细胞中多种 IL-1 依赖的信号通路发挥作用,特别是 Th17 增殖相关的 mTOR 通路 [21, 25]。
缺乏 SIGIRR 会导致自身免疫性疾病风险增加,且与疾病严重程度呈正相关。在过敏性炎症中,SIGIRR 的作用尚存在争议。在 IL-33 依赖的气道过敏性炎症中,缺乏 SIGIRR 的小鼠表现为肺炎症、脾肿大以及血清 IL-5 和 IL-13 水平升高和 Th2 细胞因子的产生增加 [26-27]。
4.3 SIGIRR 和肿瘤
炎症微环境可以促进肿瘤的发展,而肿瘤和炎症之间的关联受到内源性恶性肿瘤遗传易感基因的激活和转录,以及外源性炎症或感染的影响。这些作用机制都与核转录因子 NF-κB、信号转导与转录激活因子 3(STAT3)和缺氧诱导因子-1α(HIF-1α)的激活有关。
SIGIRR 是一种可以抑制肿瘤相关炎症反应的因子,其缺失会影响炎症相关肿瘤的发生和发展。在结肠癌模型中,SIGIRR 缺陷小鼠的结肠组织中会大量激活 NF-κB 信号,并通过影响对细胞增殖和生存至关重要的靶基因(如 Cyclin D1 和 Bcl-xL)的表达来促进肿瘤形成 [28-29]。
同时,在这些小鼠的结肠组织中还检测到了多种细胞因子(如 TNF-α、IL-6 和 IFN-γ)和趋化因子(如 MIP-2、MCP-1 和 CXCL1/KC)的表达增加。在肿瘤发展过程中,肿瘤细胞会采取多种方式来调节炎症反应以避免被机体免疫系统发现和消灭 [28-29]。
SIGIRR 可通过抑制 IL-18 通路影响 NK 细胞分化和功能成熟,在二乙基亚硝胺诱导的肝癌模型和小鼠乳腺癌模型中,均显示了 SIGIRR 对于肿瘤发展的抑制作用 [1, 30-32]。SIGIRR 作为免疫与炎症的负性调控因子,在肿瘤中的作用机制有待进一步阐明(图 4) [1]。
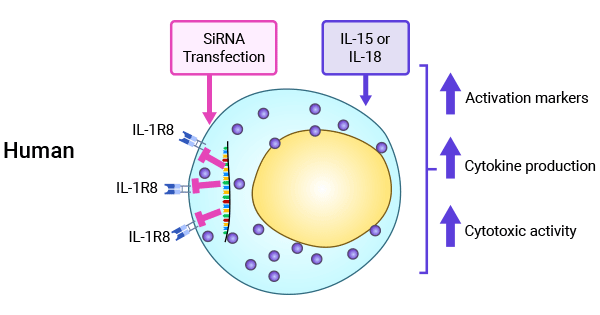
图 4. SIGIRR(IL-1R8)在调控NK细胞功能中的重要性 [1]
5. SIGIRR 的临床药物研究前景
近年来,SIGIRR 作为 TIR 家族致炎信号通路中具有鲜明特点的负调控分子,在感染性疾病、自身免疫性疾病、肿瘤等多种炎症免疫相关疾病中取得了重要进展,展现出了重要的临床应用价值。TIRs 介导的信号传导在抵抗病原微生物的固有免疫中具有重要作用,但其过度激活引起的炎性因子大量释放,则使机体的免疫稳态失衡。
SIGIRR 在炎症免疫反应中的负性调控,可维持 TIR 超家族所介导下游信号通路平衡。ILRs 和 TLRs 均属于 TIR 超家族。TIR 成员在炎症或免疫反应相关疾病中的正性促进作用已被广泛认知,但其平衡调控研究却鲜见报道。因此,SIGIRR 作为机体炎症、免疫反应的「刹车」分子,拥有巨大的临床研究价值!
为鼎力协助各药企针对 SIGIRR 在感染性疾病、自身免疫性疾病、肿瘤等多种炎症免疫相关疾病临床中的研究,CUSABIO 推出 SIGIRR 蛋白产品(Code:CSB-MP743558 HU),助力您在 SIGIRR 机制方面的研究或其潜在临床价值的探索。
Recombinant Human Single Ig IL-1-related receptor(SIGIRR),partial
High Purity Validated by SDS-PAGE
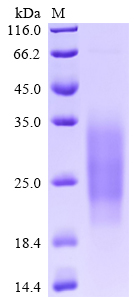
High purity was validated by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
High Purity Validated by SEC-HPLC
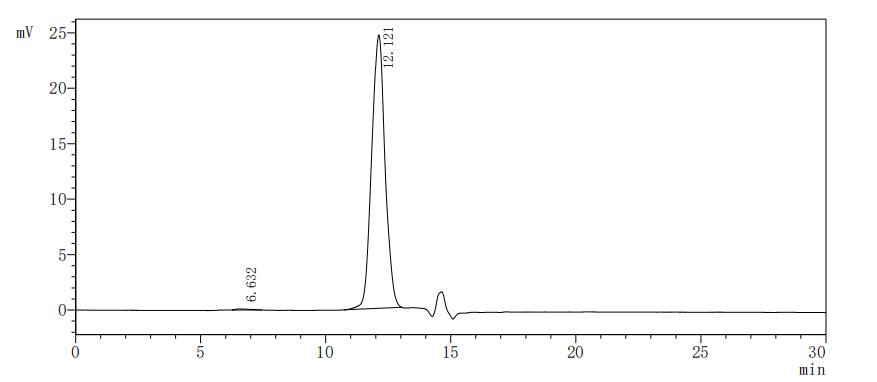
The purity of Human SIGIRR was greater than 95% as determined by SEC-HPLC.
参考文献:
[1] Mariotti F R, Supino D, Landolina N, et al. IL-1R8: A molecular brake of anti-tumor and anti-viral activity of NK cells and ILC[C]//Seminars in Immunology Academic Press, 2023, 66: 101712.
[2] Carty M, Kearney J, Shanahan K A, et al. Cell survival and cytokine release after inflammasome activation is regulated by the Toll-IL-1R protein SARM[J]. Immunity, 2019, 50(6): 1412-1424. e6.
[3] Martin M U, Wesche H. Summary and comparison of the signaling mechanisms of the Toll/interleukin-1 receptor family[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2002, 1592(3): 265-280.
[4] Huang Xun. Experimental study of SIGIRR regulating HMGB1-induced inflammatory response of alveolar epithelial cells A549. Diss. Fourth Military Medical University, 2012.
[5] Thomassen E, Renshaw B R, Sims J E. Identification and characterization of SIGIRR, a molecule representing a novel subtype of the IL-1R superfamily[J]. Cytokine, 1999, 11(6): 389-399.
[6] Lech M, Skuginna V, Kulkarni O P, et al. Lack of SIGIRR/TIR8 aggravates hydrocarbon oil-induced lupus nephritis[J]. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 2010, 220(5): 596-607.
[7] Drexler S K, Kong P, Inglis J, et al. SIGIRR/TIR-8 is an inhibitor of toll-like receptor signaling in primary human cells and regulates inflammation in models of rheumatoid arthritis[J]. Arthritis & Rheumatism, 2010, 62(8): 2249-2261.
[8] Li L, Wei J, Li S, et al. The deubiquitinase USP13 stabilizes the anti-inflammatory receptor IL-1R8/Sigirr to suppress lung inflammation[J]. EBioMedicine, 2019, 45: 553-562.
[9] Li L, Wei J, Suber T L, et al. IL-37-induced activation of glycogen synthase kinase 3β promotes IL-1R8/Sigirr phosphorylation, internalization, and degradation in lung epithelial cells[J]. Journal of cellular physiology, 2021, 236(8): 5676-5685.
[10] Wang Q, Sun Z, Xia W, et al. Role of USP13 in physiology and diseases[J]. Frontiers in Molecular Biosciences, 2022, 9: 977122.
[11] Garlanda C, Anders H J, Mantovani A. TIR8/SIGIRR: an IL-1R/TLR family member with regulatory functions in inflammation and T cell polarization[J]. Trends in immunology, 2009, 30(9): 439-446.
[12] Bertilaccio M T S, Simonetti G, Dagklis A, et al. Lack of TIR8/SIGIRR triggers progression of chronic lymphocytic leukemia in mouse models[J]. Blood, The Journal of the American Society of Hematology, 2011, 118(3): 660-669.
[13] Riva F, Bonavita E, Barbati E, et al. TIR8/SIGIRR is an interleukin-1 receptor/toll like receptor family member with regulatory functions in inflammation and immunity[J]. Frontiers in immunology, 2012, 3: 322.
[14] Heinig K, Sperandio M. Interleukin-1R8: balancing inflammation and hemostasis in platelets[J]. Cardiovascular Research, 2016, 111(4): 307-309.
[15] Molgora M, Barajon I, Mantovani A, et al. Regulatory role of IL-1R8 in immunity and disease[J]. Frontiers in immunology, 2016, 7: 149.
[16] Giannoudaki E, Stefanska A M, Lawler H, et al. SIGIRR negatively regulates IL-36-driven psoriasiform inflammation and neutrophil infiltration in the skin[J]. The Journal of Immunology, 2021, 207(2): 651-660.
[17] Costello D A, Carney D G, Lynch M A. α-TLR2 antibody attenuates the Aβ-mediated inflammatory response in microglia through enhanced expression of SIGIRR [J]. Brain, behavior, and immunity, 2015, 46: 70-79.
[18] Qin J, Qian Y, Yao J, et al. SIGIRR inhibits interleukin-1 receptor- and toll-like receptor 4-mediated signaling through different mechanisms[J]. Journal of Biological Chemistry, 2005, 280(26): 25233-25241.
[19] Zhang C, Wu X, Zhao Y, et al. SIGIRR inhibits toll-like receptor 4, 5, 9-mediated immune responses in human airway epithelial cells[J]. Molecular biology reports, 2011, 38: 601-609.
[20] Zhao R, Song C, Liu L, et al. Single immunoglobulin and Toll-interleukin-1 receptor domain containing molecule protects against severe acute pancreatitis in vitro by negatively regulating the Toll-like receptor-4 signaling pathway: A clinical and experimental study[J]. Molecular Medicine Reports, 2020, 22(4): 2851-2859.
[21] Gulen M F, Kang Z, Bulek K, et al. The receptor SIGIRR suppresses Th17 cell proliferation via inhibition of the interleukin-1 receptor pathway and mTOR kinase activation[J]. Immunity, 2010, 32(1): 54-66.
[22] Jiang Keguo. The regulation of SIGIRR on the activation of NF-κB in human renal tubular epithelial cells, the feedback regulation of NF-κB on SIGIRR and the preliminary study on the mechanism of SIGIRR regulation of EMT. Diss. Anhui Medical University, 2015.
[23] Horne D J, Randhawa A K, Chau T T H, et al. Common polymorphisms in the PKP3-SIGIRR-TMEM16J gene region are associated with susceptibility to tuberculosis [J]. Journal of Infectious Diseases, 2012, 205(4): 586-594.
[24] Garlanda C, Di Liberto D, Vecchi A, et al. Damping excessive inflammation and tissue damage in Mycobacterium tuberculosis infection by Toll IL-1 receptor 8/single Ig IL-1-related receptor, a negative regulator of IL-1/TLR signaling[J]. The Journal of Immunology, 2007, 179(5): 3119-3125.
[25] Costello D A, Watson M B, Cowley T R, et al. Interleukin-1α and HMGB1 mediate hippocampal dysfunction in SIGIRR-deficient mice[J]. Journal of Neuroscience, 2011, 31(10): 3871-3879.
[26] Martin M U. Special aspects of interleukin-33 and the IL-33 receptor complex[C]//Seminars in immunology. Academic Press, 2013, 25(6): 449-457.
[27] Lunding L, Webering S, Vock C, et al. IL-37 requires IL-18Rα and SIGIRR/IL-1R8 to diminish allergic airway inflammation in mice[J]. Allergy, 2015, 70(4): 366-373.
[28] Xiao H, Gulen M F, Qin J, et al. The Toll-interleukin-1 receptor member SIGIRR regulates colonic epithelial homeostasis, inflammation and tumorigenesis[J]. Immunity, 2007, 26(4): 461-475.
[29] Liu J, Chen Y, Liu D, et al. Ectopic expression of SIGIRR in the colon ameliorates colitis in mice by downregulating TLR4/NF-κB overactivation[J]. Immunology letters, 2017, 183: 52-61.
[30] Che Y Y, Shi X, Zhong X D, et al. Resveratrol prevents liver damage in MCD-induced steatohepatitis mice by promoting SIGIRR gene transcription[J]. The Journal of Nutritional Biochemistry, 2020, 82: 108400.
[31] Molgora M, Bonavita E, Ponzetta A, et al. IL-1R8 is a checkpoint in NK cells regulating anti-tumour and anti-viral activity[J]. Nature, 2017, 551(7678): 110-114.
[32] Bodaszewska-Lubas M, Liao Y, Zegar A, et al. Dominant-Negative Form of SIGIRR: SIGIRRΔE8 Promotes Tumor Growth Through Regulation of Metabolic Pathways[J]. Journal of Interferon & Cytokine Research, 2022, 42(9): 482-492.



