武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
细胞因子和炎症性疾病
2052 人阅读发布时间:2021-07-28 10:11
炎症是人体免疫系统的正常反应,但若无法得到有效控制,免疫系统反而攻击健康组织。而炎症疾病则是由于免疫系统攻击人体自身组织,导致炎症,如阿尔茨海默氏症、强直性脊柱炎、关节炎、哮喘、动脉硬化和克罗恩病等。
炎症是由多种可溶性因子介导。根据炎症疾病的不同类型,可将炎症细胞因子分为两类:参与急性炎症疾病的细胞因子和负责慢性炎症疾病的细胞因子。在本文中,我们将重点讨论参与急性炎症性疾病或慢性炎症性疾病的细胞因子。
1、什么是急性炎症?
2、与急性炎症有关的细胞因子
3、什么是慢性炎症?
4、与慢性炎症有关的细胞因子
什么是急性炎症?
急性炎症是指由急性炎症引起的疾病。急性炎症的持续时间较短,根据损伤程度不同,持续时间从几分钟到几天不等,常伴有发热、血白细胞数量增加,血浆中出现纤维蛋白原、C反应蛋白等急性期蛋白。一般来说,急性炎症是炎症的早期阶段,对身体健康是有好处的。
急性炎症通常以疼痛、发热、红肿和功能丧失为特征。这些症状可引起血流量和血管通透性增加,使中性粒细胞更快的到达受影响部位。这样可以保护受伤部位不受进一步的伤害,同时身体进入超速运转,抵抗细菌、病毒、病原体、受损细胞或其他刺激物,杀死入侵者和受损组织,保护身体。
与急性炎症有关的细胞因子
如前所述,细胞因子是由细胞产生的小蛋白,通过与某些细胞受体反应,作用于其他细胞。在炎症下,某些细胞因子会激活身体反应对抗感染或损伤。身体反应会以受伤或感染部位为目标,与其他细胞一起对抗损伤。图1显示了参与急性和慢性炎症性疾病的几种细胞因子。
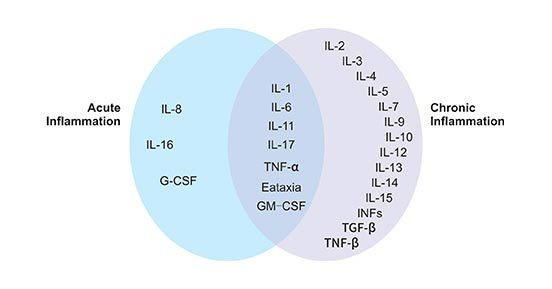
图1. 参与急性和慢性炎症反应的细胞因子
*图片来源于Frontiers in Bioscience 的出版物 [2]
几种细胞因子在介导急性炎症反应中起着关键作用,即IL-1、TNFα、IL-6、IL-11、IL-8、G-CSF和GM-CSF。在本文中,我们介绍了对急性炎症至关重要的细胞因子,包括TNFα、IL-1、IL-8和IL17。
TNFα和急性炎症性疾病
白细胞从外周血向血管外部位迁移是炎症反应的一个重要特征。TNFα由免疫细胞和实质细胞在炎症部位分泌,可通过激活内皮细胞表达免疫细胞的黏附分子,促进免疫细胞外渗。TNFα是炎症的主调节因子,能诱导许多其他炎症细胞因子和趋化因子的表达。TNFα和IL-1有几种共同的促炎特性。与IL-1一样,TNFα通过刺激下丘脑血管内皮合成PGE2,或通过释放IL-1间接诱导发热。
Philippe A. Tessier等人发现,在葡萄球菌肠毒素A(SEA,超抗原之一)诱导的急性炎症动物模型中,向气囊中施用超抗原会导致免疫活性TNFα的快速、短暂积累。在同一研究中,他们还发现,用针对TNFα的中和Abs处理小鼠,可以有效抑制白细胞招募到气囊。这些观察结果与TNFα超抗原诱导的白细胞聚集的作用是一致的[3][4]。
IL1和急性炎症性疾病
IL-1家族由IL-1α和IL-1β组成。它们主要由单核吞噬细胞、成纤维细胞、角质细胞、T和B淋巴细胞产生。与TNFα一样,IL-1也是促炎细胞因子之一,在炎症中起着至关重要的作用。IL-1α和IL-1β均可通过增强下丘脑血管内皮合成前列腺素E 2(PGE2)而引起发热,并可刺激T细胞增殖。此外,IL-1还能引起炎症部位肥大细胞释放组胺。然后,组胺引发早期血管扩张和血管通透性增加。
IL-1α和IL-1β亚型与无菌性炎症反应密切相关。在急性脑血管病中,作为急性炎症性疾病之一,IL-1α和IL-1β能使急性脑血管病恶化[5][6]。在健康的大脑中,IL-1是检测不到的,但在损伤后或疾病期间,可检测到IL-1表达。
IL-8与急性炎症性疾病
中性粒细胞渗入炎症部位是急性炎症的标志之一。据推测,局部产生的趋化因子是导致炎症部位浸润等生物反应的重要媒介。IL-8是C-X-C趋化因子的原型,在炎症部位产生,促进中性粒细胞对损伤部位的趋化作用。
N.Mukaida等人曾报道,在一些动物疾病模型中,使用IL-8中和抗体可以防止中性粒细胞介导的组织损伤,以及中性粒细胞浸润。此外,他们还发现,抗IL-8抗体能有效预防两种与临床情况非常相关的模型:内毒素血症引起的急性呼吸窘迫综合征(ARDS)样肺损伤和脑缺血再灌注损伤[7]。
IL17与急性炎症性疾病
无菌性损伤后的急性炎症是不可避免的,也是恢复平衡和促进组织修复所必需的。IL17(IL-17A)于1988年首次被发现,由于在其网状内皮系统中发现了IL17,故被称为鸡T淋巴细胞抗原-8(CTLA-8)。虽然IL17在类风湿关节炎、银屑病和癌症等慢性疾病状态中的作用已被充分研究,但其在手术、败血症或外伤后的急性炎症中的意义尚未被充分研究。最近,许多证据表明,IL17在各种器官移植患者的排斥反应中起着重要作用,其血清水平被认为是肾、肝、小肠移植中急性器官排斥的良好预后指标[8][9][10]。
什么是慢性炎症?
慢性炎症性疾病指一种持续性炎症(也称慢性炎症),并且损伤组织的疾病。患者之所以会患上慢性炎症,是因为免疫系统对其接触到的东西产生了不良反应。
慢性炎症又称迁延性炎症,能对机体组织造成相当大的损害,并导致炎症部位的细胞类型发生转变,其特点是炎症过程中组织的破坏和愈合同时进行。
炎症性疾病变成慢性的疾病包括:乳糜泻、血管炎、红斑狼疮、慢性阻塞性肺病(COPD)、肠易激激综合征、动脉硬化、关节炎和银屑病。
与慢性炎症有关的细胞因子
在介导慢性炎症反应中,起关键作用的细胞因子有,IL3、IL6、TNFβ、IL4、IL5、IL7、IL9、IL10、IL13、IL14、IFN等。本文主要介绍对慢性炎症至关重要的IL6、IL4、IL7和IL9。
IL6与慢性炎症性疾病
IL6在炎症部位产生,在急性期反应中起着关键作用。在急性炎症初期,IL-6介导急性期反应。当IL-6作为促炎细胞因子的活性持续存在时,便使急性炎症转变成慢性炎症 [12]。
在慢性炎症中,IL-6对机体具有损害作用。IL-6通过持续分泌MCP-1,加强血管增生和T细胞的抗凋亡功能,这会导致单核细胞在损伤部位聚集 [13]。与此同时,血清中IL-6的水平增加,为慢性炎症增生的提供条件。类风湿关节炎(RA)患者关节内滑膜细胞的浆细胞增多和增生是慢性炎症增生的典型例子。
IL4与慢性炎症性疾病
IL-4为15-19kDa的蛋白,以二聚体形式存在。IL-4由CD4+细胞、肥大细胞和嗜碱性细胞产生。IL-4能诱导CD4+T细胞分化为Th2细胞。它还可作为B细胞、T细胞和肥大细胞的生长因子,它能增强B细胞上II类MHC的表达,并能促进免疫球蛋白类转换为IgG1和IgE。IL-4还能刺激人真皮成纤维细胞产生胶原蛋白和IL-6,因此可能在系统性硬化症等纤维化疾病的发病过程中发挥作用。在类风湿关节炎中,IL-4表现出一定的抗炎性,它能抑制类风湿关节炎患者滑膜产生IL-1、IL-6、IL-8和TNF-α等几种促炎细胞因子。
IL7与慢性炎症性疾病
不同于大多数细胞因子,IL-7由非造血基质细胞产生,对大多数免疫细胞起着重要作用。IL-7由淋巴造血组织中的上皮细胞和间质细胞产生的。但T细胞、B细胞和自然杀伤(NK)细胞等免疫细胞不产生IL7,尽管一些树突状细胞亚群可产生少量的IL-7。几乎所有的成熟T淋巴细胞都表达IL-7受体(IL-7R)。然而,天然存在的调节性T细胞(Treg)除外,这种情况下,Treg可选择性地扼杀致病效应因子,同时保留关键的自然调节因子。
于是,许多在啮齿动物中进行的临床研究表明,靶向IL-7/IL-7R通路有希望治疗免疫介导的炎性疾病(IMID)或移植排斥的防止,并有可能恢复免疫耐受。在患有IMID的患者(如多发性硬化症、1型糖尿病、类风湿性关节炎、炎症性肠病)中观察到IL-7/IL-7R信号传导的消除和众多与IL-7R多态性相关的风险增加 [14]。
IL9与慢性炎症性疾病
IL-9最开始是作为一种30~40kDa的蛋白质被发现,由小鼠辅助性T细胞克隆在受到刀豆球蛋白(Concanavalin A)刺激后产生[15]。后来,IL-9的人类同源物被发现,且这种细胞因子由活化的人类T细胞产生的。研究表明细胞因子IL-9在许多慢性炎症性疾病和自身免疫性疾病的发病过程中起着至关重要的调节作用,比如,炎症性肠病、多发性硬化症、系统性红斑狼疮和食物过敏性哮喘等[16][17][18]。IL-9结合IL-9R可激活各类免疫和非免疫细胞。IL-9通过诱导Jak/STAT通路,调控这些细胞的分化和激活。
此外,IL-9能诱导T辅助细胞的激活,并影响粘膜中各种组织驻留细胞的功能。有研究结果表明,在自身免疫和慢性炎症性疾病的实验模型中,阻断IL-9信号传导对治疗有效。
参考文献:
[1] Brown B.N., Badylak S.F. The Role of the Host Immune Response in Tissue Engineering and Regenerative Medicine [J]. Principles of Tissue Engineering: Fourth Edition. 2013, 497-509.
[2] Carol A. Feghali, and Timothy M. Wright. Cytokines in acute and chronic inflammation [J]. Frontiers in Bioscience 2. 1997, January 1, 12-26.
[3] Philippe A. Tessier, Paul H. Naccache, et al. Induction of Acute Inflammation In Vivo by Staphylococcal Superantigens. II. Critical Role for Chemokines, ICAM-1, and TNFα [J]. J Immunol. 1998; 161:1204-1211.
[4] L. SCHNELL, DPHIL, et al. Cytokine-induced Acute Inflammation in the Brain and Spinal Cord [J]. Journal of Neuropathology and Experimental Neurology. 1999, 58(3):234-245.
[5] James Galea and David Brough. The role of inflammation and interleukin-1 in acute cerebrovascular disease [J]. J Inflamm Res. 2013, 6: 121–128.
[6] Lucas SM, Rothwell NJ, et al. The role of inflammation in CNS injury and disease [J]. Br J Pharmacol. 2006, 147:S232–S240.
[7] N. Mukaida, T. Matsumoto, et al. Inhibition of neutrophil-mediated acute inflammatory injury by an antibody against interleukin-8 (IL-8) [J]. Inflamm. res. 1998, 47, Supplement 3, S151–S157.
[8] O. Millan, L. Rafael-Valdivia, et al. Should IFN-gamma, IL-17 and IL-2 be considered predictive biomarkers of acute rejection in liver and kidney transplant? Results of a multi-centric study [J]. Clin. Immunol. 2014, 154: 141–154.
[9] L. Ma, H. Zhang, K. Hu, G. et al. The imbalance between Tregs, Th17 cells and inflammatory cytokines among renal transplant recipients [j]. BMC Immunol. 2015, 16.
[10] Vikas Sud a, Andrew Abboud, et al. IL-17A–A regulator in acute inflammation: Insights from in vitro, in vivo and in silico studies [J]. Cytokine. 2018.
[11] D. Metcalf. The colony stimulating factors. Discovery, development, and clinical applications [J]. Cancer. 1990, 65, 2185-95.
[12] Cem Gabay. Interleukin-6 and chronic inflammation [J]. Arthritis Res Ther. 2006, 8(Suppl 2): S3.
[13] Atreya R, Mudter J, et al. Blockade of interleukin-6 trans-signaling suppresses T-cell resistance against apoptosis in chronic intestinal inflammation: evidence in Crohn's disease and experimental colitis in vivo [J]. Nat Med. 2000, 6:583–588.
[14] Lyssia Belarif, Bernard Vanhove, et al. Full antagonist of the IL-7 receptor suppresses chronic inflammation in non-human primate models by controlling antigen-specific memory T cells [J]. Cell Stress. 2018, 2(12): pp. 362 – 364.
[15] C. Uyttenhove, R.J. Simpson, et al. Functional and structural characterization of P40, a mouse glycoprotein with T-cell growth factor activity [J]. Proc. Natl. Acad. Sci. U. S. A. 1988, 85: 6934–6938.
[16] G. Ruocco, S. Rossi, et al., T helper 9 cells induced by plasmacytoid dendritic cells regulate interleukin-17 in multiple sclerosis [J]. Clin Sci (Lond.). 2015, 129: 291–303.
[17] R.X. Leng, H.F. Pan, et al. Potential roles of IL-9 in the pathogenesis of systemic lupus erythematosus [J]. Am. J. Clin. Exp. Immunol. 2012, 1: 28–32.
[18] Markus F. Neurath and Susetta Finotto. IL-9 signaling as key driver of chronic inflammation in mucosal immunity [J]. Cytokine & Growth Factor Reviews. 2016 29:93-9.



