武汉华美生物工程有限公司CUSABIO®品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
线粒体内膜蛋白OMA1
4498 人阅读发布时间:2020-03-03 16:53
线粒体是细胞的主要供能细胞器,有“能量工厂”之称,也参与磷脂合成和氨基酸代谢等生化反应,同时还参与钙离子的储存和调节、细胞增殖、细胞分化及细胞死亡等活动。线粒体通过分裂、融合的动态平衡构成线粒体网络(如图1所示),也就是常说的线粒体动力学,是线粒体质量调控的重要方式[1],也一直是线粒体相关研究的热点与难点。
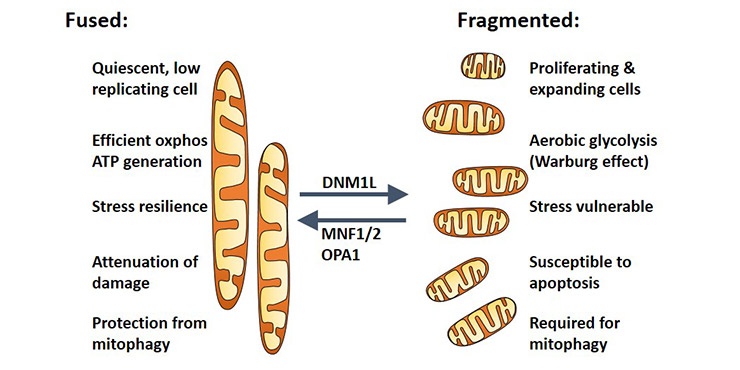
Figure 1. The function of mitochondrial network
OMA1,是一种由OMA1基因表达,不依赖于ATP的锌离子金属蛋白酶,也是一种氧化还原依赖性蛋白,有多次跨膜结构域和锌指结合基序,位于线粒体内膜。目前说法比较一致的是,OMA1可以通过调控内膜蛋白OPA1蛋白(OPA1属于核基因,编码的蛋白是线粒体内源发动蛋白,是线粒体塑形蛋白家族的成员,蛋白位于线粒体内膜,是调节线粒体内膜融合的重要蛋白)的水解,起到控制细胞线粒体分裂和融合的动态平衡[2]。而进一步阐明线粒体蛋白酶OMA1的作用机理对于探明许多疾病的发病机制有着重要的意义。在本篇文章中,我们主要从结构、功能、调节和相关疾病4个方面详细介绍了线粒体蛋白酶OMA1。
1. OMA1结构
2. OMA1功能
3. OPA1-OMA1调控机制
4. OMA1与疾病
1. OMA1结构
金属蛋白酶OMA1是由OMA1基因编码的线粒体内膜蛋白,该基因包含9外显子,位于染色体1p32.2-p32.1上,如图2所示:

Figure 2. The location of MOA1 gene
人蛋白金属内切酶OMA1由524个氨基酸组成,其中包含了位于1-13的氨基酸的信号肽,分子量大小为60.1 kDa,成熟OMA1蛋白理论上的pI为8.44[3]。该蛋白之所以被称为OMA1,是因为它与m-AAA蛋白酶具有重叠活性[4]。OMA1的人类直系同源基因是MPRP-1,起初认为是在内质网,从2003年才开始受关注。在证实OMA1线粒体定位的两项研究中同时也描述了哺乳动物的同源物N端有长度为170个氨基酸的延伸氨基末端,这可能会对高等生物的拓扑结构产生影响[5]。目前必须在生物化学上建立这种多跨膜蛋白的拓扑结构,并定位催化位点以更好地理解其调节。
2. OMA1功能
线粒体内膜上有两种AAA蛋白酶,分别是i-AAA和m-AAA蛋白酶。i-AAA蛋白酶的催化结构域面向膜间隙,而m-AAA的活性中心在线粒体基质侧。前文已提到,OMA1与m-AAA蛋白酶具有重叠的蛋白水解活性。但是,OMA1与m-AAA蛋白酶一样,并不完全调节模型底物Oxa1的转换。相反,OMA1仅产生N-和C-末端蛋白水解片段。大量研究证实,当线粒体失去膜电位或ATP时,OMA1可降解哺乳动物线粒体内膜融合蛋白OPA1。这种诱导型蛋白水解作用是蛋白水解失活OPA1的主要调节机制[6][7]。
另外,有研究表明,在OMA1缺失的条件下,OPA1在S1位点的剪切出现障碍,但线粒体的形态没有受到很大的影响,但在压力刺激下,线粒体出现片段化,需要OMA1剪切OPA1(注意,这里的S1位点是OPA1 mRNA的剪切位点,会在后面的OMA1/OPA1调控机制中详细介绍)。OMA1缺陷鼠可以存活,但会患饮食导致的肥胖症,并且机体的生热作用异常,这预示着在维持代谢平衡时,OMA1对OPA1的剪切起着重要作用[8]。
3. OPA1-OMA1调控机制
哺乳动物的OPA1在许多细胞活动中起着作用,如构筑线粒体嵴、凋亡抑制、维持mtDNA完整性和氧化磷酸化等,这些活动又与线粒体动力学相互影响。OPA1的生物合成,受到转录和翻译2个水平的调控。在哺乳动物中OPA1有许多的剪接体。OPA1 pre-mRNA在外显子4、4b和5b处选择性剪接,可产生有组织特异性的8种mRNA来编码OPA1,而且这些不同形式的OPA1剪接体有不同的功能。这些mRNA编码的多肽,除了含有线粒体基质蛋白酶MPP剪切位点外(切除线粒体引导序列),都含有S1剪切位点,有些多肽的C端含有S2剪切位点。S1、S2位点的剪切发生在外显子5或5b所编码的肽段序列,使得OPA1失去跨膜结构域。从理论上推测,任何一条mRNA经翻译后,都可以产生一条长OPA1(L-OPA1,只在MPP位点剪切)和一条或更多条短OPA1 (S-OPA1,在Sl或S2位点剪切) [9]。
相关研究表明,线粒体内膜蛋白酶OMA1及i-AAA蛋白酶YMElL分别在S1和S2位点剪切OPA1。L-OPA1可以被不同的诱导性蛋白酶剪切。L-OPA1定位在线粒体内膜上,S-OPA1定位在线粒体膜间隙。在应激条件下,如线粒体膜电势降低、ATP缺陷、凋亡等均可诱导L—OPA l的剪切。这种剪切是快速并彻底的,使OPAl完全失活。
如图3A所示,在正常生理条件下,m-AAA蛋白酶AFG3L2与 pre-pro-OMA1相互作用并切割生成pro-OMA1。产生的pro-OMA1数量可进一步受i-AAA蛋白酶YME1L1活性调节,避免其积累,此外,OMA1和YME1L1可进一步对OPA1(分别在S1和S2位点)进行剪切以确保了L-OPA1与S-OPA1两种形式之间的平衡。OMA1跨膜结构域的黄色矩形表示停止m-AAA修剪的亮氨酸延伸。
相比之下,图3B表示的是没有AFG3L2(m-AAA)的情况,此时pre-pro-OMA1到 pro OMA1的转化效率最小,会引起广泛的细胞器损伤,包括呼吸复合物的组装缺陷、ROS产生、ATP消耗和内膜前抑制应激[10],这些应激反应会激活其他蛋白酶调控的紧急通路来活化OMA1和线粒体断裂的下游作用。图3C表示的是YME1L1缺失的情况,这种情况和由此产生的pro-OMA1积累,导致的效果是一样的。这会增强其自催化活性,并且再次诱导线粒体断裂。考虑到OMA1在线粒体融合-裂变稳态中的关键作用,可以想象需要多种替代效应物,包括AFG3L2、YME1L1和OMA1本身,以及Δφ,以维持这种关键应激传感蛋白的有效微调[11]。

Figure 3. The possible mechanism of OMA1/OPA1
4. OMA1与疾病
前面已经提到OMA1目前比较公认的作用是水解OPA1蛋白。而OPA1是线粒体内源发动蛋白,在许多细胞活动中起着作用,如线粒体嵴的构筑、凋亡抑制、mtDNA完整性的维持、氧化磷酸化的维持等。人体在应激反应后,蛋白酶OMA1活化会过度水解OPA1,然后促进线粒体断裂,如果持续,则会引发体内细胞死亡和组织变性,继而引发一系列疾病,如常染色体视神经萎缩(DOA)、巴特综合征、神经退行性疾病和癌症等[12][13]。这里,我们着重介绍神经退行性疾病与癌症。
4.1 OMA1与神经退行性疾病
Anne Korwitz[14]等人利用抑制素膜支架缺失建立神经退行性疾病模型小鼠。在该小鼠模型中,作者证实了应激反应下OMA1对OPA1的水解能够促进神经元死亡和神经炎症反应,而且 OMA1的缺失可以延迟神经元丢失并延长模型组小鼠的寿命。同时这也伴随着L-OPA1的累积,这种形式的OPA1可以稳定线粒体基因组,但是不能在抑制素耗尽的神经元中维持线粒体嵴的形态及呼吸链复合物组装状态。所以L-OPA1可以独立于嵴形状促进神经元存活。这个结论在抑制素膜支架缺失的情况下也得到了证实。
4.2 OMA1与癌症
癌症细胞中存在“瓦伯格效应”(the Warburg effect)。因为肿瘤和正常成体组织存在着代谢差异,它们主要通过糖酵解产能,同时大量生成乳酸,这种代谢性质使得肿瘤细胞的耗糖速度远大于正常细胞[15]。这种肿瘤细胞对糖酵解通路产能依赖增强的现象被称为瓦伯格效应,该效应会极快地促进细胞增生和肿瘤生长。以瓦伯格效应进行代谢为主的癌症细胞,线粒体的嵴会减少[16],而OPA1也会减少,但OMA1会增多。此外,Marcel V. Alavi在BAX和BAK1依赖性细胞死亡的背景下将蛋白质OMA1和OPA1与抑制素和p53连接,建立线粒体外膜透化和细胞色素c释放的模型。该模型的核心是线粒体内膜蛋白酶OMA1,实验也证实OMA1在肿瘤环境中被激活,这也是新型个性化癌症疗法的药物靶点代表之一。
References
[1] Marcel V. Alavi. Targeted OMA1 therapies for cancer [J]. Int J Cancer. 2019 Feb 4.
[2] Pedro M. Quirós, Andrew J. Ramsay, et al. New roles for OMA1 metalloprotease from mitochondrial proteostasis to metabolic homeostasis [J]. Adipocyte. 2013, 2:1, 7–11.
[3] Kozlowski LP. IPC - Isoelectric Point Calculator [J]. Biology Direct. 2016, 11 (1): 55.
[4] Kaser, M., Kambacheld, M., et al. Oma1, a novel membrane-bound metallopeptidase in mitochondria with activities overlapping with the m-AAA protease [J]. J. Biol. Chem. 2003, 278, 46414–46423.
[5] Bao, Y.C., Tsuruga, H., et al. Identification of a human cDNA sequence which encodes a novel membrane-associated protein containing a zinc metalloprotease motif [J]. DNA Res. 2003, 10, 123-128.
[6] Ehses S, Raschke I, et al. Regulation of OPA1 processing and mitochondrial fusion by m-AAA protease isoenzymes and OMA1 [J]. The Journal of Cell Biology. 2009, 187 (7): 1023–36.
[7] Korwitz A, Merkwirth C, et al. Loss of OMA1 delays neurodegeneration by preventing stress-induced OPA1 processing in mitochondria [J]. The Journal of Cell Biology. 2016, 212 (2): 157–66.
[8] McBride H, Soubannier V. Mitochondrial function: OMA1 and OPA1, the grandmastem of mitochondrial health [J]. Current biology. 2010, 20 (6):274-276.
[9] Wang JK, Wu HF, et al. Postconditioning with sevoflu-lane protects against focal cerebral ischemia and reperfusion injury involving mitochondrial A7rP-dependent potassium channel and mitochondrial permeability transition pore [J]. Neurological research. 2015, 37(1):77—83.
[10] Maltecca, F., Aghaie, A., et al. The mitochondrial protease AFG3L2 is essential for axonal development [J]. J. Neurosci. 2008, 28, 2827-2836.
[11] Francesco Consolato1, Francesca Maltecca1. m-AAA and i-AAA complexes coordinate to regulate OMA1, the stress-activated supervisor of mitochondrial dynamics [J]. Journal of Cell Science. 2018, 131, jcs213546.
[12] Hoppins S, Lackner L, et al. The machines that divide and fuse mitochondria [J]. Annu Rev Biochem. 2007, 76:751-780.
[13] Chan DC. Mitochondrial fusion and fission in mammals [J]. Annu Rev Cell Dev Biol. 2006, 22:79 ~99.
[14] Anne Korwitz, Carsten Merkwirth, et al. Loss of OMA1 delays neurodegeneration by preventing stress-induced OPA1 processing in mitochondria [J]. J Cell Biol. 2016, 212(2): 157–166.
[15] Esen E, Chen J, et al. WNT-LRP5 signaling induces Warburg effect through mTORC2 activation during osteoblast differentiation [J]. Cell Metab. 2013, 17:745-755.
[16] Plecita-Hlavata L, Jezek P. Integration of superoxide formation and cristae morphology for mitochondrial redox signaling [J]. Int J Biochem Cell Biol. 2016, 80:31-50.






